Aktuelles
forschen / 07.03.2026
Bär: Gleichstellung in der Forschung ist wichtiger Innovationsmotor

Anlässlich des Weltfrauentags sprach Bundesforschungsministerin Dorothee Bär heute im Max Delbrück Center für Molekulare Medizin in der Helmholtz-Gemeinschaft am Standort Berlin-Mitte mit Forscherinnen über Gleichstellung in Wissenschaft und Forschung.
Dazu erklärt Bundesforschungsministerin Bär:
„Gleichstellung ist eine Notwendigkeit für die Innovations- und Zukunftsfähigkeit Deutschlands. Sie ist ein zentraler Innovationsmotor. Wir können es uns nicht leisten, auf die Hälfte der klügsten Köpfe zu verzichten, wenn wir die großen Themen und Megatrends unserer Zeit erfolgreich angehen wollen. Sei es die Digitalisierung, die Weltraumforschung, die Medizin der Zukunft oder die Schlüsseltechnologien. Daher unterstützt das Bundesforschungsministerium gemeinsam mit den Ländern die Gleichstellung an Hochschulen mit dem Professorinnenprogramm 2030 sowie die Sichtbarkeit von Forscherinnen mit der Förderrichtlinie ‚Innovative Frauen im Fokus‘. Um das gesellschaftliche Bewusstsein für die Berücksichtigung von Geschlechteraspekten in der Forschung weiter zu stärken, konzipieren wir aktuell einen wissenschaftlichen Bundespreis für Geschlechterforschung, der noch in diesem Jahr ausgerufen werden soll.“
Dazu erklärt Professorin Maike Sander, wissenschaftliche Vorständin und Vorstandsvorsitzende des Max Delbrück Center:
„Die Entdeckungen am Max Delbrück Center schaffen die Grundlagen für die Medizin der Zukunft. Dafür brauchen wir Talente, die sich für Innovationen begeistern und ihre Ideen einbringen – unabhängig von Geschlecht oder Herkunft. Insgesamt sind 60 Prozent unserer Forschenden Frauen. Auch bei den Gruppenleiterinnen, die am Anfang ihrer Karriere stehen, sind wir erfolgreich. Bei den unbefristeten Professuren haben wir weiter Nachholbedarf. Deshalb fördern wir Wissenschaftlerinnen gezielt, etwa über Mentoring-Programme. Wir suchen weltweit nach außergewöhnlichen Kandidatinnen und sprechen sie an. Mehr als die Hälfte unserer Gruppenleiterinnen haben wir international rekrutiert. Für sie alle wollen wir ein inspirierendes Umfeld schaffen. Wir brauchen eine Wissenschaftskultur, in der Karrieren nicht von Rollenbildern geprägt werden, sondern von Neugier, Talent und Mut. Es gibt einiges zu tun.“
Das Max Delbrück Center für Molekulare Medizin in der Helmholtz-Gemeinschaft legt mit seinen Entdeckungen den Grundstein für die Medizin von morgen. An unseren Standorten in Berlin-Buch, Berlin-Mitte, Heidelberg und Mannheim erforschen interdisziplinäre Teams die Komplexität von Krankheiten auf Systemebene – von Molekülen und Zellen bis hin zu Organen und dem gesamten Organismus. Gemeinsam mit Partnern aus Wissenschaft, Klinik und Industrie sowie in internationalen Netzwerken entwickeln wir innovative Ansätze für die Früherkennung, personalisierte Therapien und Prävention von Krankheiten. Das 1992 gegründete Max Delbrück Center bietet rund 1.800 Mitarbeitenden aus mehr als 70 Ländern ein vielfältiges, dynamisches und inspirierendes Arbeitsumfeld. Wir werden zu 90 Prozent durch den Bund und zu 10 Prozent durch das Land Berlin finanziert.
Foto: Von links nach rechts: Maike Sander, Katja Simon, Dorothee Bär und Ashley Sanders in einem Labor.
Maike Sander ist wissenschaftliche Direktorin des Max Delbrück Centers. Katja Simon ist Leiterin des wissenschaftlichen Talentmanagements, Dorothee Bär ist Bundesministerin für Forschung, Technologie und Raumfahrt, Ashley Sanders ist wissenschaftliche Gruppenleiterin.
© Felix Petermann, Max Delbrück Center
Quelle: Pressemitteilung Max Delbrück Center
Bär: Gleichstellung in der Forschung ist wichtiger Innovationsmotor
forschen, bilden / 06.03.2026
Viele Preise bei „Jugend forscht” in Berlin-Buch

Es ging um Teichwasser, Pestizide und Chili im Boden: Beim regionalen Wettbewerb von „Jugend forscht“ präsentierten 85 Schüler*innen auf dem Campus Berlin-Buch 43 Projekte. Unter dem Motto „Maximale Perspektive“ hatten sie sich mit Neugier und kreativen Ideen ganz realen Herausforderungen gestellt.
Carlo ging jeden Tag auf dem Weg zur Schule an einem Teich vorbei. Er fragte sich immer, wie sauber das Wasser darin wohl sei. Cosima wollte wissen, ob Pestizide die Populationen einer Bakterienart dezimieren, die im Boden für die Stickstofffixierung wichtig sind. Und Fin wollte herausfinden, ob Capsaicin – der Hauptwirkstoff von Chili, der auf der Zunge brennt und kribbelt – das Wachstum von Gemüse beeinflussen kann.
Es sind nur ein paar der von Neugier getriebenen Fragen, die Berliner Schüler*innen in Projekte verwandelt haben, die sie am 25. Februar 2026 beim regionalen Wissenschaftswettbewerb „Jugend forscht“ im Max Delbrück Communications Center (MDC.C) auf dem Campus Berlin-Buch präsentierten.
Um zukunftsorientiertes Denken zu fördern, lautete das diesjährige Motto „Maximale Perspektive“. Die Schüler*innen konnten Projekte aus den Bereichen Biologie, Chemie, Physik oder Technik einreichen, die innovative Lösungen für gesellschaftliche Probleme bieten, und dabei ihr kreatives und kritisches Denken beweisen.
Spaß und Neugier sind entscheidend
Ulrich Scheller, Leiter des Campus Berlin-Buch, eröffnete die Veranstaltung mit einer Begrüßungsrede. Er ermunterte die Schüler*innen, „Spaß zu haben und immer neugierig zu bleiben“. Im Laufe des Nachmittags stellten insgesamt 85 Schüler*innen im Alter zwischen 8 und 20 Jahren ihre 43 wissenschaftlichen Projekte den Jurymitgliedern und dem Publikum vor.
Carlo, ein Sechstklässler, hatte eine schwimmende Plattform mit einem Loch gebaut, durch die er das Teichwasser mit verschiedenen Sonden auf den Säuregehalt und andere Schadstoffe testen konnte. Cosima hatte herausgefunden, dass das Pestizid Glyphosat – ein gängiges Unkrautvernichtungsmittel – eine Bakterienart schädigen kann, die für die Stickstofffixierung im Boden wichtig ist. Und Fin hatte beobachtet, dass Capsaicin, wenn es dem Boden zugesetzt wird, das Wurzelwachstum von Gartenkresse hemmt.
Oft hatten persönliche Erlebnisse die Schüler*innen zu ihren Projekten inspiriert. Ein Team des Käthe-Kollwitz-Gymnasiums beispielsweise hatte eine Kamerahalterung für eine Drohne gebaut, mit der sich detailliertere Bilder von Menschen aufnehmen lassen als mit vielen handelsüblichen Kameras. Die Idee dazu kam von einem Schüler, dessen Großeltern eine Überschwemmung miterlebt hatten. Die Rettungskräfte hatten die Menschen, die damals evakuiert werden mussten, nur schwer finden können.
Mehrere Schüler*innen äußerten sich bestürzt über die zunehmende Verschmutzung der Ozeane durch Plastikmüll – was ihr Interesse geweckt hatte, biologisch abbaubare Kunststoffe zu entwickeln.
Forschung beginnt mit Fragen
Vor der Preisverleihung am Freitag, dem 27. Februar, konnten alle Interessierten an einem Experimentierkurs im Gläsernen Labor und an mehreren Führungen teilnehmen – durch Labore des Max Delbrück Center, des Leibniz-Forschungsi2nstituts für Molekulare Pharmakologie (FMP) und des Campusunternehmens FyoniBio.
Am Nachmittag vergab die Jury die Preise, darunter Geld, Abonnements für wissenschaftliche Zeitschriften und Besuche von Ausstellungen – in zwei separaten Altersgruppen „Jugend forscht Junior“ und „Jugend forscht“ sowie in verschiedenen Kategorien: Biologie, Chemie, Physik, Technik. Außerdem wurde ein Sonderpreis in der Kategorie Interdisziplinär vergeben. Die Erstplatzierten haben sich für den Landeswettbewerb an der Technischen Universität Berlin qualifiziert.
Darüber hinaus gab es mehrere Sonderpreise in allen naturwissenschaftlichen Kategorien und Extra-Kategorien wie Umwelttechnik und Engagement. Gesponsert hatten diese Preise unter anderem das Max Delbrück Center, das FMP, das Experimental and Clinical Research Center (ECRC), das Gläserne Labor und der Campus Berlin-Buch.
„Wir freuen uns sehr, dass wir die Begeisterung junger Menschen für die Wissenschaft wecken können“, sagte Kirsten Bodensiek, die Administrative Vorständin des Max Delbrück Center, während der Feierstunde zu den Schüler*innen. „Wissenschaft beginnt nicht mit Antworten, sondern mit klugen Fragen. Mit euren Projekten leistet ihr einen Beitrag zur Wissenschaft von morgen.“
„Es ist wirklich toll, euch jedes Jahr hier zu sehen“, fügte Dr. Henning Otto, Wissenschaftlicher Referent am FMP, hinzu. „Ihr seid einfach großartig! Wenn ihr eine Karriere in der Wissenschaft anstrebt, dann wählt einen Ort wie diesen – einen wunderbaren Campus mit ganz vielen neugierigen Menschen.“
Die Preisträger:
Biologie
Preisstifterin ist die Helmholtz Gemeinschaft Deutscher Forschungszentren e.V.
3. Platz: Marie Thürling, Frieda Kliche, Charlotte Lange
Hans-und-Hilde-Coppi-Gymnasium
„Wie verändert sich der Vitamingehalt von Obst durch verschiedene Verarbeitungen?“
3. Platz: Marek Ebert
Käthe-Kollwitz-Gymnasium
„Hydroponik von Anfang an“
2. Platz: Klas Koesling
Rosa-Luxemburg-Gymnasium
„Verwendung von Kaffeeabfällen zur Herstellung von hochwertigen Tierfutterbestandteilen“
1. Platz: Cosima Höer, Moritz Pasternak
Freie Universität Berlin, Primo-Levi-Gymnasium
„Stickstofffixierende Bodenbakterien – Haben Pestizide und Dünger einen Einfluss?“
Biologie Jugend forscht Junior
3. Platz: Carlo Kühn
Primo-Levi-Gymnasium
„Untersuchung des Kreuzpfuhls“
1. Platz: Leif Neuberger, Oskar Kubitschko, Julian Dietrich
Lessing-Gymnasium
„Stopp den Schimmel – Naturfarben im Test“
Der 2. Platz wurde nicht vergeben.
Chemie
Preisstifter ist der Fonds der Chemischen Industrie im Verband der Chemischen Industrie e.V. (VCI).
3. Platz: Cedric Neuberger
Lessing-Gymnasium
„Atemkalk – Unser Klimaretter?“
2. Platz: Pepe Fynn Jost, Sarah Herrmann, Anna Skrabania
Primo-Levi-Gymnasium
„Eigenbau eines Gaschromatographen“
1. Platz: Giulia-Matilda Oettel
Lessing-Gymnasium
„Self-Healignin – Entwicklung eines faserverstärkenden Thermoplasts auf Ligninbasis“
Chemie Jugend forscht Junior
1. Platz: Lina Ebert
Heinrich-Roller-Grundschule
„Der Curry-Fleck muss weg!“
Physik
Preisstifterin ist die Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V.
3. Platz: Vico Grollmus, Maria Anufrieva
Primo-Levi-Gymnasium
„3D-gedrucktes Interferometer für Schülerexperimente“
2. Platz: Magnus Vogel
Robert-Havemann-Gymnasium
„Aufbau, Kalibrierung und Nutzung eines 3m-Radioteleskops“
1. Platz: Kari Linnea Geisinger
Herder-Gymnasium
„Der Teebeutel-Oszillator“
Physik Jugend forscht Junior
1. Platz: Lino Phielipeit, Simon Wiese
Primo-Levi-Gymnasium
„Tischtennis Reloaded“
Technologie
Preisstifter ist der Verein Deutscher Ingenieure e.V. (VDI).
3. Platz: Rasmus Wilke
Käthe-Kollwitz-Gymnasium
„Autonomes Messboot zur Erfassung von Gewässerdaten“
2. Platz: Tony Nguyen
Käthe-Kollwitz-Gymnasium
„FokusPilot – Lernruhe mit Eigensteuerung“
1. Platz: Conrad Speiser
Rosa-Luxemburg-Gymnasium
„Firebug – Bionischer Infrarotsensor zur intelligenten Branderkennung“
1. Platz / Interdisziplinär: Siddharta Kollar, Iulia Dinu
Käthe-Kollwitz-Gymnasium
„Sentr: die automatisierte Lösung für Warenlogistik im Supermarkt“
Technologie Jugend forscht Junior
2. Platz: Ryan Bartsch, Rodja Cichos
Primo-Levi-Gymnasium
„Micro-mouse“
Der 1. Platz wurde nicht vergeben.
Quelle: Max Delbrück Center
Viele Preise bei „Jugend forscht” in Berlin-Buch
investieren, produzieren / 03.03.2026
T-knife Therapeutics Announces Authorization of Clinical Trial Application for TK-6302, A Multi-Armored, CRISPR based T cell Therapy for Solid Tumors
Phase 1 ATLAS trial to evaluate TK-6302 in patients with advanced PRAME-positive solid tumors authorized for initiation
SAN FRANCISCO and BERLIN, March 03, 2026 - T-knife Therapeutics, Inc., a biopharmaceutical company developing next-generation T cell therapies to fight cancer, today announced the authorization of its Clinical Trial Application (CTA) to begin the Phase 1 ATLAS trial of TK-6302 in Europe. TK-6302 is a multi-armored PRAME-targeted T cell therapy specifically engineered to overcome the challenges associated with treating solid tumor cancers. The ATLAS trial, which is poised to begin this year, is an adaptive, first-in-human, open-label, Phase 1 trial of TK-6302 in patients with advanced PRAME-positive solid tumors.
“We are proud to achieve this important milestone, which enables the initiation of the Phase 1 ATLAS clinical trial and our transition to becoming a clinical-stage company,” stated Thomas M. Soloway, President and Chief Executive Officer of T-knife. “TK-6302 is a highly differentiated therapy, engineered for greater potency against PRAME, a clinically validated target with attractive commercial potential. PRAME is highly prevalent across multiple high unmet-need solid tumor indications, including squamous non-small cell lung, ovarian, endometrial, skin, and triple-negative breast cancers. Today’s announcement reflects the dedication, expertise, and urgency our team brings to transforming innovative science into life-changing therapies.”
Peggy Sotiropoulou, Ph.D., Chief Scientific Officer of T-knife, added, “The CTA was supported by a comprehensive and compelling preclinical data package demonstrating TK-6302’s best-in-class anti-tumor efficacy. By bolstering T-cell fitness and persistence while overcoming challenging tumor mediated immune barriers, TK-6302 has the potential to deliver meaningful clinical benefit, including deep, durable responses across a range of solid tumor cancers. Bringing a first-of-its-kind multi-armored, CRISPR gene-edited T cell therapy into the clinic underscores our commitment to pushing scientific boundaries in the service of delivering transformative therapies to patients.”
About TK-6302
TK-6302 is a PRAME-targeted T cell therapy that has been “supercharged” by the inclusion of multiple armoring innovations: a high affinity PRAME targeting receptor to enhance cytotoxicity; a costimulatory CD8 coreceptor to engage CD4 T cells and enhance T cell fitness and persistence; and a FAS-based checkpoint converter designed to boost engraftment and promote T cell survival in the hostile tumor micro-environment. Preclinical data with TK-6302 demonstrated sustained serial killing and cytokine secretion in a model mirroring the inhibitory ligand expression in PRAME-expressing tumors. In a complex 3-dimensional (3D) spheroid tumor model, TK-6302 eliminated multiple rounds of tumors and demonstrated superior anti-tumor activity compared to controls. TK-6302 is manufactured with a non-viral gene editing process for improved T cell receptor expression, and it has been successfully manufactured at-scale using the clinical process.
About T-knife Therapeutics
T-knife is a biopharmaceutical company dedicated to developing T cell therapies to deliver broad, deep and durable responses to solid tumor cancer patients. The company’s unique approach leverages its proprietary platforms and synthetic biology capabilities to design the next-generation of supercharged T cells with best-in-class potential.
T-knife was founded by leading T cell and immunology experts utilizing technology developed at the Max Delbrück Center for Molecular Medicine together with Charité – Universitätsmedizin Berlin, is led by an experienced management team, and is supported by a leading group of international investors, including Andera Partners, EQT Life Sciences, RA Capital Management and Versant Ventures. For additional information, please visit the company’s website at www.t-knife.com.
www.t-knife.comforschen / 25.02.2026
Darmmikroben steuern übers Gehirn unser Herz
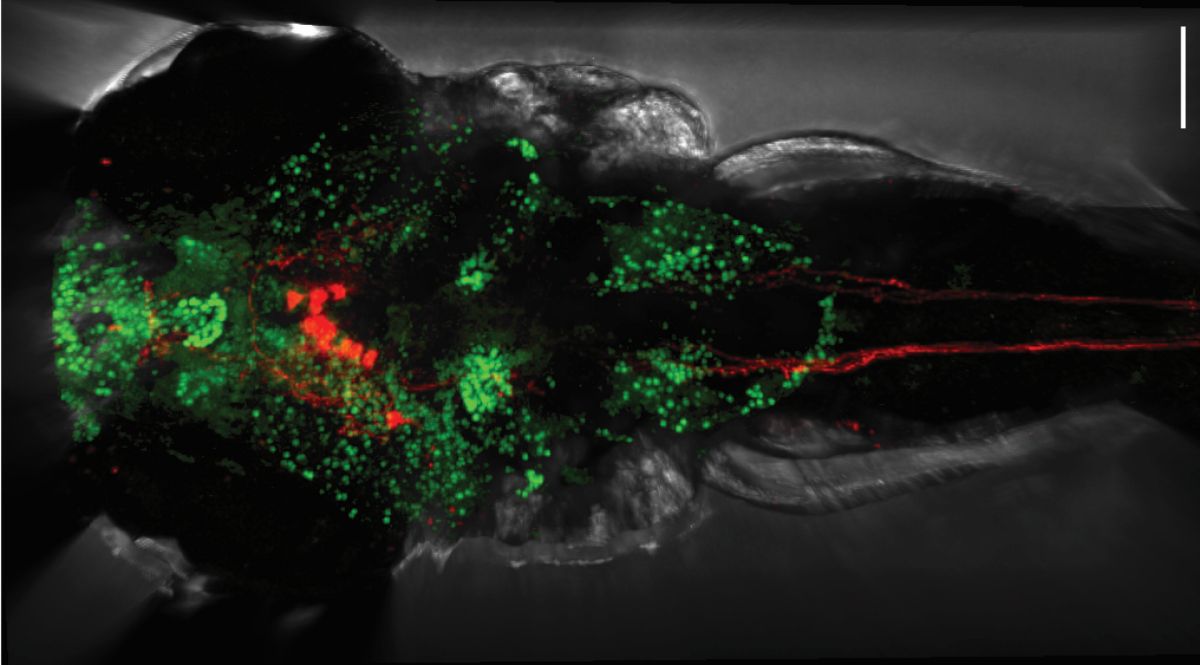
Ein Stoffwechselprodukt von Bakterien in unserem Darm steuert über Zellen des Gehirns die Herzfunktion. Die bisher unbekannte Darm-Hirn-Herz-Achse stellt ein Team des Max Delbrück Center in „Circulation Research“ vor. Sie weist einen Weg zu möglichen Therapien für Bluthochdruck und Herzinsuffizienz.
Millionen von Menschen weltweit leiden an Bluthochdruck oder Herzinsuffizienz. Ursache ist in vielen Fällen eine diastolische Dysfunktion – hervorgerufen durch einen zunehmend steifen Herzmuskel, der nur noch schwer entspannen und sich dabei vollständig mit Blut befüllen kann. Warum das Herz versteift, ist bisher nicht im Detail verstanden.
Ein Team um Dr. Suphansa Sawamiphak, Leiterin der Arbeitsgruppe „Kardiovaskulär-Hämatopoetische Interaktion“ am Max Delbrück Center, hat jetzt herausgefunden, dass Darmbakterien eine entscheidende Rolle in diesem Krankheitsprozess spielen könnten. In Experimenten mit Zebrafischen als Modell entdeckten die Forschenden, dass bestimmte Mikroben im Darm aus der Aminosäure Tryptophan ein kleines Molekül namens Indol-3-Essigsäure (IES) produzieren. IES wirkt auf Neuronen im Gehirn, die wiederum das Herz steuern. Sawamiphak und ihre Kolleg*innen stellen diesen direkten Draht zwischen Bakterien, Hirn und Herz im Fachblatt „Circulation Research“ vor.
„Wir waren überrascht, dass ein einzelner bakterieller Metabolit gleichzeitig das zentrale Nervensystem, das Herz und zudem wichtige Hormonsysteme beeinflussen kann“, sagt die Erstautorin der Studie, Bhakti Zakarauskas-Seth aus Sawamiphaks Team. „Das zeigt, dass das Gehirn als zentrale Schaltstelle in der Kommunikation zwischen Darm und Herz fungieren kann.“
Bluthochdruck durch überaktive Neuronen
Um zu verstehen, wie Darmbakterien das Herz beeinflussen könnten, konzentrierten sich die Forschenden auf eine Gruppe von Neuronen im Hypothalamus von Zebrafischlarven, die bestimmte Neuropeptide, die Hypocretine (Hcrt), herstellen. Diese Botenstoffe, auch bekannt als Orexine, regulieren im Körper viele unwillkürliche Funktionen, etwa das Schlaf- und Hunger, aber auch die Herzaktivität. Sank bei den Zebrafischlarven der IES-Spiegel, wurden die Hcrt-Neuronen überaktiv. Dies verstärkte ihre sympathischen Nervensignale an das Herz, wodurch der Herzmuskel versteifte und seine Fähigkeit, sich vollständig zu entspannen, nachließ.
Wenn die Wissenschaftler*innen den Larven IES verabreichten, normalisierte sich die neuronale Aktivität. Die Herzfunktion und der Blutdruck verbesserten sich und sogar verwandte Hormone wie Renin und Angiotensinogen kehrten zu gesünderen Werten zurück.
Im nächsten Schritt untersuchten Zakarauskas-Seth und ihre Kolleg*innen Daten einer Gruppe von Patient*innen. Denn auch wir Menschen besitzen Hcrt-Neuronen. Die Forschenden stellten fest, dass die IES-Werte bei Patient*innen mit Bluthochdruck reduziert waren. Bemerkenswert war, dass sie einen geschlechtsspezifischen Effekt beobachteten: Frauen mit Bluthochdruck wiesen in ihren Serumproben signifikant niedrigere IES-Werte auf als Männer, die an Hypertonie litten.
Zur Prävention und Therapie
Die diastolische Dysfunktion ist sehr verbreitet – fast die Hälfte aller Menschen über 70 Jahren weisen zumindest leichte Symptome auf. Sie ist die Ursache der Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF), an der mehr als 50 Prozent der Patient*innen mit Herzschwäche leiden.
Für diese Menschen eröffnen die Ergebnisse ihrer Arbeit mehrere Möglichkeiten, sagt Zakarauskas-Seth: „Der IES-Spiegel könnte als Biomarker dienen, um Patientinnen und Patienten mit einem hohen Risiko für Bluthochdruck oder Herzinsuffizienz zu identifizieren. Und therapeutisch könnten gesteigerte IES-Konzentrationen – etwa durch die Ernährung, Probiotika oder Nahrungsergänzungsmittel – eine neue Strategie sein, um Herz-Kreislauf-Erkrankungen vorzubeugen oder zu behandeln.“
Dass ein einzelnes bakterielles Stoffwechselprodukt das zentrale Nervensystem, das Herz und das Hormonsystem beeinflussen könne, sei eine wichtige Botschaft, fügt Zakarauskas-Seth hinzu. „Der Körper funktioniert nicht in isolierten Kompartimenten: Die Darmgesundheit, das mikrobielle Gleichgewicht und die Ernährung wirken sich direkt darauf aus, wie gut das Herz funktioniert.“ Die Forschenden wollen ihre Ergebnisse jetzt zunächst in anderen Tiermodellen validieren. Um herauszufinden, welchen Nutzen Patient*innen aus einem gesteigerten IES-Spiegel tatsächlich ziehen können, werden zudem klinische Studien erforderlich sein.
Bild: Rückenansicht einer Zebrafischlarve: Aktive Nervenzellen sind grün, Hypocretine herstellende Neurone und ihre Ausläufer rot dargestellt. © Bhakti Zakarauskas-Seth, AG Sawamiphak, Max Delbrück Center
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft legt mit seinen Entdeckungen von heute den Grundstein für die Medizin von morgen. An den Standorten in Berlin-Buch, Berlin-Mitte, Heidelberg und Mannheim arbeiten unsere Forschenden interdisziplinär zusammen, um die Komplexität unterschiedlicher Krankheiten auf Systemebene zu entschlüsseln – von Molekülen und Zellen über Organe bis hin zum gesamten Organismus. In wissenschaftlichen, klinischen und industriellen Partnerschaften sowie in globalen Netzwerken arbeiten wir gemeinsam daran, biologische Erkenntnisse in praxisnahe Anwendungen zu überführen – mit dem Ziel, Frühindikatoren für Krankheiten zu identifizieren, personalisierte Behandlungen zu entwickeln und letztlich Krankheiten vorzubeugen. Das Max Delbrück Center wurde 1992 gegründet und vereint heute eine vielfältige Belegschaft mit rund 1.800 Menschen aus mehr als 70 Ländern. Wir werden zu 90 Prozent durch den Bund und zu 10 Prozent durch das Land Berlin finanziert.
Quelle: Pressemitteilung Max Delbrück Center
Darmmikroben steuern übers Gehirn unser Herz
forschen / 24.02.2026
Unterschiedliche Rollen für zwei ähnliche Enzyme
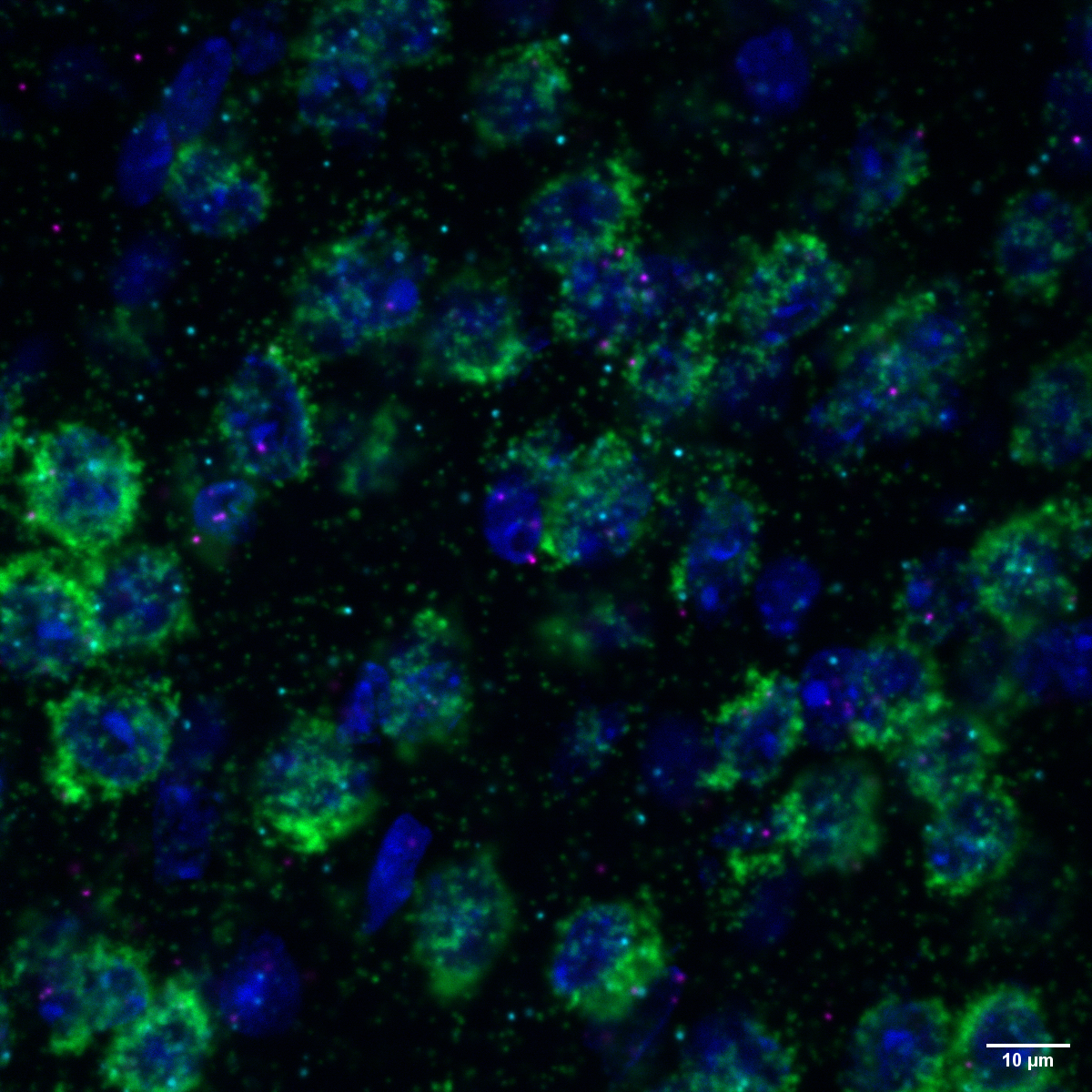
Zwei eng verwandte Enzyme, MNK1 und MNK2, spielen im Gehirn sehr unterschiedliche Rollen und regulieren jeweils ein anderes Verhalten. Wie Forschende vom Max Delbrück Center in „Molecular Psychiatry“ erläutern, kann dieses Wissen helfen, präzisere Therapien für neurologische Erkrankungen zu entwickeln.
Strukturell sehen sie ähnlich aus: MNK1 und MNK2 gehören zur selben Enzymfamilie und sind vor allem dafür bekannt, dass sie die Proteinproduktion der Zellen regulieren. Aufgrund ihrer herausragenden Rolle bei dieser wichtigen Zellfunktion stehen sie als potenzielle Ziele für Wirkstoffe gegen neurologische Erkrankungen und chronische Schmerzen im Rampenlicht. Doch was wäre, wenn ein Medikament nur auf eines dieser Enzyme abzielen würde?
Eine Antwort auf diese Frage möchte ein Team um Rosalba Olga Proce, Doktorandin in der Arbeitsgruppe „Molekulare und zelluläre Grundlagen des Verhaltens“ von Dr. Hanna Hörnberg am Max Delbrück Center, finden. In einer jetzt im Fachblatt „Molecular Psychiatry“ vorgestellten Studie haben die Forschenden untersucht, ob die beiden Enzyme – Kinasen genannt – im Gehirn unterschiedliche Funktionen erfüllen.
Die Wissenschaftler*innen stellten deutliche Unterschiede fest: Mäuse ohne MNK1 zeigten weniger Interesse an neuen Objekten als andere Artgenossen und konnten sich später zudem nur schlecht an sie erinnern. Mäuse ohne MNK2 besaßen diese Auffälligkeiten nicht, hatten aber ein gesteigertes Interesse an sozialen Kontakten.
„Die Verhaltensunterschiede, die wir beobachtet haben, deuten darauf hin, dass jede dieser Kinasen im Gehirn eine spezielle Funktion hat“, sagt Proce. „Bei der Entwicklung von Medikamenten könnte es daher sinnvoll sein, die beiden Enzyme einzeln anzusprechen.“
Mäuseverhalten und molekulare Daten
Um herauszufinden, wie es zu den Verhaltensänderungen kommt, nutzten die Wissenschaftler*innen gentechnisch veränderte Mäuse, bei denen entweder das MNK1- oder das MNK2-Gen ausgeschaltet war. Die Ergebnisse ihrer Verhaltenstests verglichen sie im Anschluss mit groß angelegten molekularen Analysen des Hirngewebes.
Das Team konzentrierte sich insbesondere auf die Großhirnrinde und die Synapsen – die Kontaktstellen, über die Nervenzellen miteinander kommunizieren. Mit verschiedenen Methoden, der Proteomik, Transkriptomik und Phosphoproteomik, analysierten die Forschenden in beiden Mäusegruppen die Proteinkonzentrationen, die Genexpression und die Proteinphosphorylierungsmuster.
Wie sie berichten, wiesen Mäuse ohne MNK1 eine Fülle ribosomaler Proteine auf, die eine zentrale Rolle bei der Translation spielen – der Produktion von Proteinen anhand der Boten-RNA. Bei Mäusen ohne MNK2 waren hingegen die Expression und die Phosphorylierung von Proteinen beeinträchtigt, die an der Signalübertragung an den Synapsen beteiligt sind.
Vor allem aber stellte das Team fest, dass die molekularen Unterschiede zwischen den beiden Enzymen in den Synapsen sehr viel ausgeprägter waren als in Proben aus dem gesamten Gehirn. „Das hat uns überrascht“, sagt Hörnberg. „Denn diese Beobachtung deutet darauf hin, dass die Kinasen im Zellkörper womöglich andere Funktionen haben als in den Synapsen.“
Für präziser wirkende Medikamente
Anstatt unspezifisch beide Kinasen zu hemmen, könnten künftige Therapien selektiv auf das eine oder das andere Enzym abzielen, um präzisere Wirkungen zu erhalten, fügt Hörnberg hinzu.
Sie und ihre Kolleg*innen wollen jetzt weitere Moleküle identifizieren, mit denen MNK1 und MNK2 interagieren. Außerdem planen sie, genauer zu untersuchen, wie die beiden Kinasen die Translation von Boten-RNA in Proteine im Verlauf der synaptischen Plastizität regulieren – wenn also die Verbindungen zwischen Nervenzellen mit der Zeit stärker oder schwächer werden. Die synaptische Plastizität ist der grundlegende Mechanismus, über den das Gedächtnis und das Lernen funktionieren, und der es dem Gehirn ermöglicht, sich aufgrund von Erfahrungen neu zu vernetzen.
Ziel der Forschenden ist es nun, im Detail zu verstehen, wie die Zellen ihre Proteinsynthese an den Synapsen regulieren. So hoffen sie die Grundlage für präzisere Interventionen bei neurologischen und psychiatrischen Erkrankungen zu schaffen.
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft legt mit seinen Entdeckungen von heute den Grundstein für die Medizin von morgen. An den Standorten in Berlin-Buch, Berlin-Mitte, Heidelberg und Mannheim arbeiten unsere Forschenden interdisziplinär zusammen, um die Komplexität unterschiedlicher Krankheiten auf Systemebene zu entschlüsseln – von Molekülen und Zellen über Organe bis hin zum gesamten Organismus. In wissenschaftlichen, klinischen und industriellen Partnerschaften sowie in globalen Netzwerken arbeiten wir gemeinsam daran, biologische Erkenntnisse in praxisnahe Anwendungen zu überführen – mit dem Ziel, Frühindikatoren für Krankheiten zu identifizieren, personalisierte Behandlungen zu entwickeln und letztlich Krankheiten vorzubeugen. Das Max Delbrück Center wurde 1992 gegründet und vereint heute eine vielfältige Belegschaft mit rund 1.800 Menschen aus mehr als 70 Ländern. Wir werden zu 90 Prozent durch den Bund und zu 10 Prozent durch das Land Berlin finanziert.
Bild: Schnitt eines Mausgehirngewebes, der zeigt, dass die Boten-RNA für MNK1 (Magenta) und die MNK2-Kinase (Türkis) – wichtige Enzyme, die die Produktion von Proteinen regulieren – beide in exzitatorischen Neuronen (Grün) im Kortex exprimiert werden.
© Erika Uddström, Hörnberg Lab, Max Delbrück Center
Quelle: Pressemitteilung Max Delbrück Center
Unterschiedliche Rollen für zwei ähnliche Enzyme
forschen, produzieren, heilen / 18.02.2026
Weichen stellen, um Innovationskraft zu sichern

Landespolitik besuchte den Campus Berlin-Buch anlässlich der IHK-Roadshow zum Gesundheitsstandort Berlin 2030
Auf Einladung der IHK Berlin informierten sich am 17. Februar Mitglieder des Abgeordnetenhauses von Berlin auf dem Campus Berlin-Buch über Innovationsbedingungen in der Gesundheitswirtschaft und darüber, wie Berlin als international führender Gesundheitsstandort bis 2030 gestärkt werden kann.
In ihrem aktuellen Positionspapier „Gesundheitsstandort Berlin 2030“ sieht die IHK als Kernthemen, um die Innovationskraft Berlins zu stärken, u.a. eine schnellere Umsetzung von Forschung in marktfähige Lösungen, einen verlässlichen Zugang zu Daten und Räumen, eine reibungslose Infrastruktur- und Kapitalnutzung sowie eine dauerhafte Integration internationaler Fachkräfte.
Innovationstreiber und Motor der Gesundheitsbranche: Campus Berlin-Buch
Dr. Christina Quensel, Geschäftsführerin der Campus Berlin-Buch GmbH und Prof. Dr. Maike Sander, Wissenschaftliche Vorständin des Max Delbrück Center, begrüßten die Gäste im Gründerzentrum BerlinBioCube und stellten Buch als Berliner Zukunftsort vor.
In Berlin-Buch arbeiten rund 6.500 Menschen in der Gesundheitswirtschaft, davon rund 3.000 auf dem Wissenschafts- und Biotechcampus. Exzellente biomedizinische Forschungseinrichtungen und einer der größten Biotechparks bilden ein starkes Ökosystem für Innovationen. Bedeutende Spin-offs wie T-knife, Captain T Cell oder Tubulis haben ihren Ursprung in der hiesigen Forschung. Der Campus hat das Potenzial, gemeinsam mit neuen Firmen, weiteren Forschungsinstituten oder Pharma-Partnern Innovationssysteme und Hubs weiter auszubauen. Benachbarte Flächen sind bereits für Neuansiedlungen und wachsende Biotech-Firmen reserviert. „Start-ups benötigen die Interaktion mit anderen Start-ups, sie benötigen schnell Partner und Zugang zu Hochtechnologien – all dies bietet unser Standort“, so Dr. Quensel.
Neue Hubs in Berlin wie das Bayer Co.Lab oder das CLIC begrüßt Dr. Quensel als komplementäre Entwicklungen, die die Innovationskraft der Stadt stärken.
Standortbedingungen verbessern – in Buch und berlinweit
Als wichtige Entwicklungsthemen für den Standort wurden eine bessere Verkehrsanbindung und der Bau von Wohnungen für Mitarbeitende benannt.
Dr. Andreas Hüser, Geschäftsführer von CheckImmune, einer Ausgründung aus der Charité, gab in den Räumen seines Start-ups einen Einblick in Herausforderungen, mit denen sich Gründer in den Life Sciences in Berlin konfrontiert sehen. „Wir benötigen in unserer Stadt einen Wandel. Wer gründen möchte, sollte Unterstützung von allen Beteiligten bekommen. Damit wir Sogwirkung in ganz Europa und darüber hinaus entwickeln, brauchen wir für unsere Innovationen hochqualifizierte Sparringpartner in den Regulierungsbehörden und eine deutlich schlankere Bürokratie. Behörden sollten sich als Unterstützer verstehen.“ Dr. Verena Schöwel, CEO und Mitgründerin des Campus-Spin-offs MyoPax ergänzte: „Das Warten auf Genehmigungen kostet Start-ups Geld, weil inhaltlicher Fortschritt in dieser Phase blockiert ist.“
Diskutiert wurde eine mögliche Orientierung an Best-Practise-Lösungen anderer Bundesländer, die weniger komplizierte Zulassungsbedingungen haben.
Potenzial sieht Dr. Hüser auch darin, Netzwerke mit VC-Investoren zu intensivieren, um Life-Science-Innovationen stärker als Teil von DeepTech ins Rampenlicht zu rücken. Es gäbe in Berlin mit seiner hochkarätigen Forschungslandschaft und dem wachsenden Mindset für Gründungen alle Voraussetzungen dafür.
Dr. Quensel betonte, dass Deutschland hervorragende Förderbedingungen für die Entwicklung wissenschaftlicher Innovationen böte, aber privates Kapital unabdingbar sei, um neue Medikamente auf den Markt zu bringen: „Eine künftige bessere Gesundheitsversorgung darf nicht am Geld scheitern.“
Hidden Champion mit globaler Perspektive
Im Anschluss besuchten die Abgeordneten die Konzernzentrale der Eckert & Ziegler SE auf dem Campus. Der Vorstandsvorsitzende, Dr. Harald Hasselmann, stellte das global agierende Unternehmen mit Schwerpunkt Radiopharmazie vor, das in 30 Jahren weltweit Standorte aufgebaut hat und über 1.000 Mitarbeitende hat.
Dr. Hasselmann zeigte noch einmal auf, wie bedeutsam eine verbesserte Anbindung für den Standort ist und unterstrich die Wichtigkeit von schnelleren Bearbeitungszyklen bei Genehmigungen.
Anhand des von IHK Berlin, Gesundheitsstadt Berlin und VBKI entwickelten Positionspapiers wurden im Anschluss politische Rahmenbedingungen diskutiert für eine schlankere Regulatorik, für eine Strategie zur einheitlichen Erfassung und Nutzung von Gesundheitsdaten für die Forschung sowie die Bindung von Tech-Talenten.
Lars Mölbitz, IHK Berlin, betonte: „Das Positionspapier zeigt ganz praktisch, welche Hürden den Berliner Gesundheitsstandort bremsen und wie sich diese Hürden überwinden lassen. Der Abbau dieser Hürden kann die Gesundheitswirtschaft Berlins deutlich voranbringen.“
Link zum Positionspapier: https://www.ihk.de/berlin/gesundheitsstandort-2030
forschen / 18.02.2026
Mit neuen Materialien zu besseren MRT-Bildern
Tiefer liegende Gewebe oder kleine anatomische Details lassen sich im MRT oft nur ungenau darstellen. Forschende des Max Delbrück Center stellen in „Advanced Materials“ eine Hochfrequenz-Antenne vor, die die Bildqualität erhöht und die Scan-Dauer verkürzen kann – auch bei schon bestehenden Geräten.
Die Magnetresonanztomographie (MRT) zählt zu den wichtigsten bildgebenden Werkzeugen in der medizinischen Diagnostik. Manche Gewebe im Inneren des Körpers – zum Beispiel die anatomisch feinen Strukturen des Auges, der Augenhöhle und des Gehirns – lassen sich bisher allerdings nur unscharf abbilden. Das liegt in der Regel nicht am Scanner selbst, sondern an der Hardware, die Signale im Radiofrequenzbereich sendet und empfängt.
Forschende um Nandita Saha, Doktorandin in der Arbeitsgruppe „Experimentelle Ultrahochfeld-MR“ von Professor Thoralf Niendorf, und Kolleg*innen des Universitätsklinikums Rostock haben jetzt aus neuartigen Materialien eine MRT-Antenne entwickelt, die diese Einschränkungen überwindet: Sie liefert schärfere Bilder in kürzerer Zeit und lässt sich auch in schon bestehenden MRT-Geräten einsetzen. Das Team hat sie in der Fachzeitschrift „Advanced Materials“ vorgestellt.
„Mit den von uns entwickelten Metamaterialien konnten wir die im MRT entstehenden Hochfrequenzfelder effizienter lenken und zeigen, wie moderne Physik die medizinische Bildgebung verbessern kann“, sagt Niendorf, der Hauptautor der Studie. „Unsere Arbeit weist einen Weg zu schnelleren, klareren MRT-Scans, von denen Patientinnen und Patienten mit den unterschiedlichsten Erkrankungen profitieren können.“
Antennen aus künstlich hergestellten Werkstoffen
Eine MRT funktioniert, indem das Gerät Radiofrequenzsignale (RF-Signale) in den Körper sendet und gleichzeitig erfasst, wie das Gewebe in einem starken Magnetfeld darauf reagiert. Je klarer das Signal ist, desto besser wird das Bild. Herkömmliche MRT-Antennen, auch RF-Spulen genannt, haben jedoch oft Schwierigkeiten, Signale aus tiefen oder anatomisch komplexen Regionen zu empfangen. Dies führt zu längeren Scan-Zeiten oder detailärmeren Bildern.
Gelöst hat das Team um Niendorf dieses Problem, indem es die RF-Spule mit elektromagnetischen Metamaterialien neu konstruiert hat. Dabei handelt es sich um künstlich hergestellte Werkstoffe, die mit elektromagnetischen Wellen auf eine Weise interagieren, wie es natürliche Materialien nicht tun. Durch die Integration der Metamaterialien in die MRT-Antenne haben die Forschenden eine neue Art von RF-Hardware entwickelt, die die Signalstärke aus dem Zielgewebe erhöht, die Bildschärfe verbessert und eine schnellere Datenerfassung ermöglicht.
Entscheidend für die klinische Praxis ist zudem, dass die Antenne in bestehende MRT-Systeme passt, sodass keine neue Infrastruktur erforderlich wird. Validiert haben die Wissenschaftler*innen ihre Technologie anhand von MRT-Bildern des Auges, der Augenhöhle und des Gehirns bei einer Gruppe von Freiwilligen. Niendorf und sein Team arbeiteten dabei eng mit Forschenden des Universitätsklinikums Rostock zusammen und kombinierten so Expertise in MRT-Physik mit klinischer Ophthalmologie und translationaler Bildgebung.
Die Forschenden konnten zeigen, dass ihr System für den routinemäßigen klinischen Einsatz geeignet ist. „Wir sehen eine klare Relevanz für Anwendungen in der Augenheilkunde. Die neue Technologie ermöglicht anatomisch detaillierte MRT-Bilder des Auges mit hoher räumlicher Auflösung und Weichteilkontrast“, sagt Professor Oliver Stachs, Koautor der Publikation von der Universitätsmedizin Rostock. „Sie öffnet die Sicht auf (patho)physiologische Prozesse, die bislang weitgehend unzugänglich waren.“
„Unser Ziel war es, die MRT-Hardware ausgehend von der modernen Physik des Antennendesigns neu zu überdenken“, erläutert Saha. Das jetzt entwickelte System lasse sich auch so einstellen, dass empfindliche Körperbereiche während der MRT-Aufnahme geschützt werden – etwa um eine unerwünschte Erwärmung in der Nähe medizinischer Implantate zu reduzieren, fügt die Forscherin hinzu. Darüber hinaus könne man es nutzen, um die RF-Energie für MRT-gesteuerte Therapien von Krebserkrankungen stärker zu fokussieren, zum Beispiel zur gezielten therapeutischen Erwärmung von Tumoren, der Hyperthermie, oder um erkranktes Gewebe mittels Hitzeablation zu zerstören.
Bessere Diagnosen, kürzere Scans
Für Patient*innen können MRT-Untersuchungen unangenehm und zeitaufwändig sein, vor allem wenn Aufnahmen wiederholt werden müssen, weil wichtige Details schwer zu erkennen sind. Klarere Bilder bedeuten, dass Ärzt*innen Diagnosen mit größerer Sicherheit stellen können. Schnellere Untersuchungen haben zur Folge, dass Patient*innen weniger Zeit im Scanner verbringen müssen, was Stress und Unbehagen reduzieren kann – insbesondere bei Kindern, älteren Erwachsenen und Menschen, für die MRT-Untersuchungen wegen der Enge der Röhre und des Lärms, die das Verfahren mit sich bringt, eine Herausforderung darstellen.
Da die neue Antenne leicht und kompakt ist, lässt sie sich zudem so gestalten, dass sie sich besser an bestimmte Körperteile anpasst, was den Komfort noch weiter erhöht. Niendorf und seine Kolleg*innen planen bereits größere Studien an mehreren Krankenhäusern und passen das Design der Antenne für andere Organe wie Herz und Nieren an.
Die neue Technologie könne, leicht modifiziert, sogar MRT-Systeme unterstützen, die den Stoffwechsel oder den Transport von Medikamenten im Körper sichtbar machen, sagt Niendorf. Auch spezielle MRT-Scans, die Natrium- oder Fluorkonzentrationen im Körper räumlich abbilden, könnten dem Forscher zufolge von der Antenne aus Metamaterialien profitieren – und klarere Signale sowie bessere Bilder liefern.
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft legt mit seinen Entdeckungen von heute den Grundstein für die Medizin von morgen. An den Standorten in Berlin-Buch, Berlin-Mitte, Heidelberg und Mannheim arbeiten unsere Forschenden interdisziplinär zusammen, um die Komplexität unterschiedlicher Krankheiten auf Systemebene zu entschlüsseln – von Molekülen und Zellen über Organe bis hin zum gesamten Organismus. In wissenschaftlichen, klinischen und industriellen Partnerschaften sowie in globalen Netzwerken arbeiten wir gemeinsam daran, biologische Erkenntnisse in praxisnahe Anwendungen zu überführen – mit dem Ziel, Frühindikatoren für Krankheiten zu identifizieren, personalisierte Behandlungen zu entwickeln und letztlich Krankheiten vorzubeugen. Das Max Delbrück Center wurde 1992 gegründet und vereint heute eine vielfältige Belegschaft mit rund 1.800 Menschen aus mehr als 70 Ländern. Wir werden zu 90 Prozent durch den Bund und zu 10 Prozent durch das Land Berlin finanziert.
Quelle: Max Delbrück Center
Mit neuen Materialien zu besseren MRT-Bildern
forschen / 06.02.2026
Professur für Leif Si-Hun Ludwig

Leif Si-Hun Ludwig erhält eine Heisenberg-Professur für Stammzelldynamiken und Mitochondriale Genomik am Berlin Institute of Health at Charité (BIH). Die Deutsche Forschungsgemeinschaft (DFG) fördert die prestigeträchtige Position.
Seit gut fünf Jahren leitet Professor Leif Si-Hun Ludwig die Emmy Noether-Arbeitsgruppe „Stammzelldynamiken und Mitochondriale Genomik“ am Berlin Institute of Health at Charité (BIH) und am Max Delbrück Center. Am 1. Februar 2026 hat der Wissenschaftler eine gleichnamige Heisenberg-Professur am BIH angetreten, die die Deutsche Forschungsgemeinschaft (DFG) fördert. Nach der fünfjährigen Förderlaufzeit wird das BIH die Professur verstetigen.
Wie Blutzellen gebildet werden
Unser Blut erneuert sich ständig: Millionen neuer Zellen ersetzen jede Sekunde alte Blut- und Immunzellen. Sie entwickeln sich aus hämatopoetischen, also blutbildenden Stammzellen im Knochenmark und reifen über mehrere Entwicklungslinien zu roten und weißen Blutkörperchen, zu Thrombozyten sowie B- und T-Zellen heran. Während sich die Anzahl der Zellen im Blut routinemäßig in der Klinik oder beim Arztbesuch in einer Blutprobe messen lässt, ist der einzelne Beitrag der vielen Tausenden von Stammzellen zur Blutproduktion nur schwer abschätzbar.
Indem Forschende natürliche Mutationen in der menschlichen DNA untersuchen, erhalten sie fundamentale Einblicke in das Verhalten von Stammzellen, etwa um die Blutbildung aufrechtzuerhalten oder auch bei krankhaften Veränderungen. Einzelne Mutationen in unserem Erbgut mit drei Milliarden Basenpaaren zu finden, ist trotz modernster Methoden aber teuer und fehleranfällig.
Forschung an den Zellkraftwerken
Ludwig konzentriert sich in seiner Forschung auf natürliche Mutationen im mitochondrialen Genom – einem kleinen, ringförmigen DNA-Molekül in den Mitochondrien, den Kraftwerken der Zelle. Mithilfe modernster Technologien zur Einzelzell-Sequenzierung analysiert er Zehntausende von Knochenmarks- und Blutzellen gleichzeitig und macht die Aktivität der blutbildenden Stammzellen sichtbar.
Diese einzelzellbasierte Analyse natürlicher genetischer Variation erlaubt auch Aussagen über den Gesundheitszustand einzelner Zellen. Im klinischen Alltag könnte das Verfahren daher künftig helfen, den Erfolg von Stammzell-Transplantationen vorherzusagen oder Zellersatz- und Gentherapien gezielt zu verbessern.
Darüber hinaus interessiert sich Ludwig für angeborene Veränderungen im mitochondrialen Genom, die zu einer Vielzahl unterschiedlicher Erkrankungen des Energiestoffwechsels führen und zahlreiche Organsysteme in Mitleidenschaft ziehen. Obwohl mitochondriale Erkrankungen zu den häufigsten angeborenen genetischen Defekten zählen, sind ihre molekularen Ursachen bislang unzureichend verstanden. Ludwig erforscht, wie mitochondriale Genvarianten verschiedene Zell- und Stoffwechsel-Phänotypen beeinflussen – mit dem Ziel, eine Grundlage für neue therapeutische Ansätze zu schaffen.
„Das Heisenberg-Programm fördert herausragende Forscherinnen und Forscher. Der Erfolg von Leif S. Ludwig kam für uns daher nicht unerwartet”, sagt Professor Christopher Baum, Vorsitzender des Direktoriums des BIH und Vorstand des Translationsforschungsbereichs der Charité. „Seine exzellente Arbeit verknüpft Grundlagenforschung und anwendungsorientierte Anforderungen. Leif S. Ludwig und sein Team stärken damit das translationale Netzwerk von BIH, Charité und Max Delbrück Center zum Wohle von Patientinnen und Patienten.”
forschen / 06.02.2026
Professur für Mina Gouti

Mina Gouti ist auf eine Professur an der Charité – Universitätsmedizin Berlin berufen worden. Die Ernennung stärkt ihre wegweisende Forschung zu Organoiden am Max Delbrück Center und vertieft die Zusammenarbeit mit Kliniker*innen, um gemeinsam personalisierte Medizin weiterzuentwickeln.
Dr. Mina Gouti, Leiterin der Arbeitsgruppe „Stammzell-Modellierung der Entwicklung und Erkrankung“ am Max Delbrück Center, ist zur W3-Professorin für komplexe Organoidmodelle der personalisierten Medizin an der Medizinischen Fakultät der Charité – Universitätsmedizin Berlin berufen worden. Die unbefristete Professur würdigt ihren Beitrag bei der Entwicklung fortschrittlicher Organoidsysteme, mit denen sie untersucht, wie sich bestimmte Rückenmarksneuronen und Skelettmuskelzellen während der Entwicklung räumlich und zeitlich ausbilden.
„Diese Professur ermöglicht es meinem Team, Berlins außergewöhnliches Biomedizin-Ökosystem noch besser zu nutzen und eng mit den Kliniker*innen der Charité zusammenzuarbeiten, um komplexe Organoide für die personalisierte Medizin zu entwickeln“, sagt Gouti. Diese enge Zusammenarbeit ist unerlässlich, um mit Hilfe patientenspezifischer Organoidmodelle klinisch relevante Erkenntnisse zu gewinnen.“
Die Arbeitsgruppe von Gouti hat dreidimensionale neuromuskuläre Organoide aus humanen pluripotenten Stammzellen entwickelt. Diese bilden zentrale Eigenschaften von Rückenmarksneuronen und Skelettmuskelzellen nach und dienen als leistungsfähige Plattform, um neuromuskuläre Erkrankungen wie die spinale Muskelatrophie und die Amyotrophe Lateralsklerose zu untersuchen sowie Wirkstoffe zu testen. Solche Organoide lassen sich zudem aus Zellen einzelner Patient*innen herstellen, um deren spezifische Erkrankung gezielt zu modellieren.
Die Professur steht für die gemeinsame Vision des Max Delbrück Center und der Charité, translationale Forschung zu beschleunigen, indem Kliniker*innen und Forschende enger zusammenarbeiten. „Wir haben nun die langfristige Perspektive, um komplexe, funktionale Organoide als prädikative Plattformen für die personalisierte Medizin und eine frühe Krankheitsintervention zu entwickeln“, sagt Gouti. „Unsere Forschung soll dazu beitragen, die Gesundheitsergebnisse nicht nur für Menschen mit neuromuskulären Erkrankungen zu verbessern, sondern auch für diejenigen, die ein hohes Risiko haben, diese zu entwickeln.“
Text: Gunjan Sinha
Weiterführende Informationen
forschen, produzieren / 05.02.2026
Pentixapharm veröffentlicht positive Phase II-Daten zur Pentixafor-PET-Diagnostik
Studie bestätigt PENTIXAFOR-PET als nicht-invasive Alternative zur Nebennierenvenenkatheterisierung bei primärem Aldosteronismus
-
In der Studie wurde [68Ga]Ga-Pentixafor PET/CT gut vertragen und zeigte eine hohe Spezifität sowie eine moderate Sensitivität bei der Identifikation unilateral aldosteronproduzierender Adenome im Vergleich zur Nebennierenvenenkatheterisierung (AVS) und zu den postoperativen biochemischen Ergebnissen.
-
Die Daten stärken die klinische Grundlage für die Phase-3-Entwicklung und unterstreichen die Rolle der molekularen Bildgebung bei der Therapieentscheidung für Patientinnen und Patienten mit Hypertonie und zugrunde liegendem primärem Aldosteronismus.
Die Pentixapharm Holding AG (Frankfurter Wertpapierbörse, Prime Standard: PTP), ein fortgeschrittenes klinisches Biotechnologieunternehmen mit Fokus auf innovative Radiopharmazeutika, gab heute die Veröffentlichung neuer klinischer Phase-2-Daten im Journal of Nuclear Medicine bekannt. Die Ergebnisse belegen das Potenzial von [68Ga]Ga-Pentixafor PET/CT als nicht-invasives Bildgebungsverfahren zur Subtypisierung des primären Aldosteronismus (PA), der häufigsten endokrinen Ursache für Bluthochdruck.
Die vom Prüfarzt initiierte und von der australischen philanthropischen CASS Foundation und dem australischem Medical Research Future Fund finanzierte prospektive Phase-2-Kohortenstudie wurde in Australien durchgeführt. Ziel war es, [68Ga]Ga-Pentixafor PET/CT als mögliche Alternative zur Nebennierenvenenkatheterisierung (AVS) zu bewerten, dem derzeitigen Goldstandard zur Unterscheidung zwischen unilateral aldosteronproduzierenden Nebennierenadenomen und bilateraler Erkrankung. AVS ist invasiv, ressourcenintensiv und nur in hochspezialisierten Zentren verfügbar, was eine zeitnahe und präzise Patientenselektion erschwert.
Die online veröffentlichten Ergebnisse zeigen, dass [68Ga]Ga-Pentixafor PET/CT im Vergleich zu AVS und postoperativen biochemischen Ergebnissen eine hohe Spezifität und eine moderate Sensitivität bei der Identifikation unilateral aldosteronproduzierender Adenome erreichte. Darüber hinaus wurde das Verfahren gut vertragen und von den Patientinnen und Patienten klar bevorzugt: 28 von 29 Studienteilnehmenden gaben PET/CT als bevorzugte diagnostische Methode an.
„Diese Daten liefern wichtige Hinweise darauf, dass die molekulare Bildgebung mit [68Ga]Ga-Pentixafor PET/CT eine präzise und patientenfreundliche Subtypisierung des primären Aldosteronismus ermöglichen kann“, sagte Dr. Elisabeth Ng vom Hudson Institute of Medical Research und der Endocrinology Unit von Monash Health, leitende Prüferin der Studie. „Die hohe Spezifität ist besonders relevant für die Identifikation von Patientinnen und Patienten, die von einer kurativen Operation profitieren können, während die klare Präferenz für PET/CT das Potenzial zur breiteren Akzeptanz und besseren Zugänglichkeit der Diagnostik unterstreicht.“
In die Studie wurden Erwachsene mit primärem Aldosteronismus und einem in der CT sichtbaren Nebennierenadenom eingeschlossen. Die diagnostische Leistungsfähigkeit wurde anhand von PET-basierten Lateralitätsindizes im Vergleich zu AVS-Ergebnissen sowie biochemischen Parametern nach Adrenalektomie bewertet. Die Ergebnisse unterstützen den klinischen Nutzen von [68Ga]Ga-Pentixafor PET/CT als nicht-invasives Entscheidungsinstrument zur Identifikation von Patientinnen und Patienten, die für eine kurative Operation infrage kommen.
„Diese veröffentlichten Daten bauen auf früheren vom Prüfarzt initiierten Studien auf, einschließlich der CASTUS-Step-1-Studie, und zeigen eine reproduzierbare diagnostische Performance über unabhängige Studien und geografische Regionen hinweg“, sagte Dirk Pleimes, CEO und CMO von Pentixapharm. „Gemeinsam stärken diese Ergebnisse die klinische Basis unseres Programms zum primären Aldosteronismus und untermauern die Bereitschaft für die Phase-3-Entwicklung. Pentixapharm treibt parallel seine klinische und regulatorische Strategie voran und steht im engen Austausch mit Prüfern, Behörden und potenziellen Partnern, um den klinischen und kommerziellen Wert unserer molekularen Bildgebungsplattform zu maximieren.“
Vor dem Hintergrund neuer therapeutischer Ansätze, darunter Aldosteronsynthase-Inhibitoren, für therapieresistente Hypertonie gewinnt eine präzise und skalierbare Subtypisierung des primären Aldosteronismus zunehmend an Bedeutung. Nicht-invasive Bildgebungslösungen könnten dabei eine Schlüsselrolle spielen, um Therapieentscheidungen zu optimieren und Behandlungsergebnisse zu verbessern.
Der vollständige Artikel mit dem Titel „Identification of Aldosterone-Producing Adrenal Adenomas Using [68Ga]Ga-Pentixafor PET/CT in an Australian Cohort“ ist im Journal of Nuclear Medicine verfügbar.
Über [68Ga]Ga-PentixaFor bei therapieresistenter Hypertonie und primärem Aldosteronismus
[68Ga]Ga-PentixaFor ist ein neuartiges gallium-68-markiertes Radiodiagnostikum zur selektiven Visualisierung des Chemokinrezeptors CXCR4 mittels hochauflösender PET/CT-Bildgebung. Klinische Erfahrungen mit [68Ga]Ga-PentixaFor PET/CT bei rund 1.600 Patientinnen und Patienten in verschiedenen Indikationen belegen die Fähigkeit zur nicht-invasiven Darstellung der CXCR4-Expression in vivo.
Neuere Forschungsergebnisse zeigen eine starke CXCR4-Überexpression in aldosteronproduzierenden Nebennierentumoren – ein charakteristisches Merkmal des unilateralen primären Aldosteronismus. Diese Erkrankung ist eine häufige, historisch jedoch unterdiagnostizierte Ursache sekundärer Hypertonie, da die zuverlässige Unterscheidung zwischen unilateraler und bilateraler Erkrankung mit bestehenden Methoden schwierig ist. Während die unilaterale Form in der Regel chirurgisch behandelt wird, erfordert die bilaterale Erkrankung eine lebenslange medikamentöse Therapie. Durch die Visualisierung der CXCR4-Expression in aldosteronproduzierendem Gewebe kann [dGa]Ga-PentixaFor eine präzisere Subtypisierung ermöglichen und so zu gezielteren Therapieentscheidungen beitragen.
Über die prospektive Phase-2-Pilotstudie
Die prospektive Pilotstudie schloss Erwachsene mit primärem Aldosteronismus und einem im CT sichtbaren Nebennierenadenom ein und evaluierte [68Ga]Ga-PentixaFor PET/CT als nicht-invasive nuklearmedizinische Alternative zur AVS. Bewertet wurden diagnostische Genauigkeit und Akzeptanz im Vergleich zu AVS in einer multiethnischen Population. PentixaFor wurde von der Pentixapharm AG bereitgestellt. Die Studie wurde vorab online im Journal of Nuclear Medicine (JNM) veröffentlicht, einer führenden peer-reviewten Fachzeitschrift für molekulare Bildgebung, PET/CT und Theranostik.
Über Pentixapharm
Pentixapharm ist ein biotechnologisches Unternehmen im fortgeschrittenen klinischen Entwicklungsstadium, das die Grenzen der Radiopharmazeutika erweitert. Das Unternehmen mit Hauptsitz in Berlin entwickelt präzisionsmedizinische Diagnostika und Therapeutika in den Bereichen Onkologie und Kardiologie mit dem Ziel, die Patientenversorgung nachhaltig zu verbessern.
Die klinische Pipeline von Pentixapharm basiert auf CXCR4-gerichteten PET/CT-Programmen, darunter ein Phase-3-reifer Kandidat zur verbesserten Diagnostik von Patientinnen und Patienten mit primärem Aldosteronismus und arterieller Hypertonie. Dieser Ansatz soll eine gezielte Behandlung der zugrunde liegenden Ursachen des Bluthochdrucks ermöglichen. Darüber hinaus umfasst die CXCR4-Plattform wegweisende therapeutische Programme für hämatologische Krebserkrankungen.
Ergänzend entwickelt Pentixapharm eine Antikörper-Plattform der nächsten Generation gegen CD24, einen neuartigen Immun-Checkpoint-Marker, der in mehreren schwer behandelbaren Tumorarten überexprimiert ist. Gestützt auf ein starkes geistiges Eigentum rund um CXCR4 und CD24 sowie eine verlässliche Isotopen-Lieferkette ist Pentixapharm gut positioniert, um einen nachhaltigen medizinischen Nutzen für Patientinnen und Patienten zu schaffen und langfristiges Wachstum in einem der dynamischsten Bereiche der Präzisionsmedizin zu erzielen.
produzieren / 29.01.2026
Eckert & Ziegler liefert wie geplant und erzielt 2025 erneut Rekordjahr
Geschäftsjahr 2025 (vorläufig):
- Umsatz: rund 312 Mio. € (VJ: 295,8 Mio. €)
- EBIT vor Sondereinflüssen: rund 78 Mio. € (VJ: 65,9 Mio. €)
- Nettogewinn: rund 48 Mio. € (VJ: 33,3 Mio. €)
Die Eckert & Ziegler SE (ISIN DE0005659700, TecDAX) hat nach vorläufigen, ungeprüften Zahlen für das GJ 2025 einen Konzernumsatz von rd. 312 Mio. € und ein bereinigtes EBIT von rd. 78 Mio. € erzielt. Der Umsatz liegt rd. 5%, das bereinigte EBIT sogar rd. 18% über dem Wert des Vorjahres. Der Nettogewinn (aus fortgeführten und nicht fortgeführten Geschäftsbereichen), über den an dieser Stelle nur noch vergleichend berichtet wird, steigt auf rd. 48 Mio. EUR (VJ: 33,3 Mio. €).
Die Prognose für das Geschäftsjahr 2026 wird am 26. März 2026 gemeinsam mit dem vollständigen, testierten Jahresabschluss für das Geschäftsjahr 2025 veröffentlicht.
Über Eckert & Ziegler.
Die Eckert & Ziegler SE gehört mit über 1.000 Mitarbeitern zu den führenden Anbietern von isotopentechnischen Komponenten für Nuklearmedizin und Strahlentherapie. Das Unternehmen bietet weltweit an seinen Standorten Dienstleistungen und Produkte im Bereich der Radiopharmazie an, von der frühen Entwicklung bis hin zur Kommerzialisierung. Die Eckert & Ziegler Aktie (ISIN DE0005659700) ist im TecDAX der Deutschen Börse gelistet.
Wir helfen zu heilen.
investieren / 29.01.2026
OMEICOS Therapeutics Announces Positive Phase 2 Study Outcome Demonstrating OMT-28’s Potential in Primary Mitochondrial Diseases (PMD)
Trial Results Support Transition into Late-Stage Development with Program Expected to be Phase 2b/3-ready in H2 2026
OMEICOS, a clinical-stage biopharmaceutical company developing first-in-class small molecule therapeutics for mitochondrial and inflammatory disorders, announced the successful conclusion of its multi-centre, open-label Phase 2a PMD-OPTION Study evaluating its lead program OMT-28 in patients with Primary Mitochondrial Disease (PMD). The study results demonstrate OMT-28’s therapeutic potential to improve the physical condition in PMD based on significant recovery of the impaired mitochondrial fitness in the responding patients. The study further underscored the excellent safety and tolerability profile of OMT-28, which has now been evaluated in more than 220 individuals. OMEICOS is preparing for a potentially pivotal Phase 2b/3 study in PMD patients with myopathy and/or cardiomyopathy across EU and US sites and expects to be ready to initiate this study later this year, subject to the completion of partnering discussions.
PMD represents a heterogeneous group of conditions including the more prevalent subtypes MELAS, non-MELAS, and MIDD. PMD patients suffer from debilitating and life-threatening health consequences, such as severely limited physical stamina and disease-related changes in the heart and skeletal muscles, as well as associated neurological disorders. OMT-28, an orally available biased modulator, targets the GPCR-receptor S1PR1 (Sphingosine-1-Phosphate Receptor 1 thereby driving downstream activation of the mitochondrial sirtuin family members SIRT1 and SIRT3. By targeting S1PR1 and activating SIRT1/SIRT3, OMT-28 combines immunomodulation with mitochondrial protection—a dual mechanism to tackle inflammation and energy deficits in primary mitochondrial diseases.
“Improving physical performance through enhanced mitochondrial metabolism and reduced oxidative stress holds great promise in PMD. Our PMD-OPTION study results indicate a strong correlation between OMT-28 treatment, the observed positive impact on mitochondrial bioenergetics and fitness, and relevant clinical improvements in functional measures, which could translate into significant patient benefit,” said Dr. Robert Fischer, CEO/CSO of OMEICOS Therapeutics. “The profound effects on NAD⁺ and GSH levels, as well as simultaneous improvement of the NAD⁺/NADH and GSH/GSSG ratios we have seen in the responder group, are integrative indicators of electron transport chain function improvements and cellular redox homeostasis. Overall, the results offer a robust path for late-stage development.”
Study Design and Results Summary
The PMD-OPTION study enrolled a total of 29 PMD patients with mitochondrial tRNA point mutations or single mtDNA deletions across nine expert sites in Germany, Italy, and The Netherlands. The study generated strong interest among patients and key opinion leaders (KOLs), resulting in timely recruitment and a high degree of compliance with the study protocol and follow-up appointments. The study included a 12-week untreated run-in phase as an integrated control, capturing the patients’ natural history and baseline parameters for evaluating treatment results. Subsequently, all patients received a 24 mg once-daily dose of OMT-28 for a treatment period of up to 24 weeks. The study ended after a subsequent four-week follow-up period. The level of GDF-15, a prospective biomarker for reflecting cellular stress and inflammation, was used as a screening and inclusion criteria, while reduction of GDF-15 was used as a primary endpoint next to demonstrating safety and tolerability in PMD patients. The study outcome did not support the choice of GDF-15 in this setting suggesting that OMT-28 is acting downstream of the release mechanism of GDF-15.
To assess clinically meaningful improvements in the study population, the PMD-OPTION study utilized a combination of objective exercise endpoints and patient-reported outcomes. Using these measures, the study demonstrated a response rate of more than 60%. In the 12-Minute Walk Test (12 MWT) and the 5x Sit-to-Stand Test (5xSST), both accepted endpoints for pivotal studies, the entire study population showed improvements over baseline, while OMT-28 responders exhibited profound and statistically significant (12 MWT) clinical improvements compared to non-responders.
These results strongly correlated with a highly significant increase in total NAD+ levels in the responder group compared to baseline, and a clear separation between responders and non-responders in NAD+/NADH ratios over the course of the study. In patients responding to OMT-28 treatment, mean NAD+ levels were approximately 30% higher compared to baseline, bringing this crucial indicator of mitochondrial energy metabolism and redox status close to healthy ranges. Similarly, OMT-28 demonstrated a significant improvement in total GSH and GSH/GSSG ratios—key indicators of reduced oxidative stress in mitochondrial diseases—thereby reestablishing normal, healthy levels and even showing a trend toward further enhancement. Together, these results demonstrate that OMT-28’s ability to normalize both NAD⁺/NADH and GSH/GSSG ratios addresses the core pathologies of PMD—energy deficiency and oxidative stress—differentiating it from single-mechanism approaches and supporting its potential as a first-in-class therapy.
About OMEICOS
OMEICOS Therapeutics has discovered a series of metabolically robust synthetic analogues of omega-3 fatty acid-derived epoxyeicosanoids that have the potential to treat mitochondrial dysfunction, inflammatory, cardiovascular and other diseases. Epoxyeicosanoids activate cell type-specific endogenous pathways that promote organ and tissue protection. OMEICOS’ small molecules are orally available and show improved biological activity and pharmacokinetic properties compared to their natural counterparts. For more, please visit: www.omeicos.com
bilden / 29.01.2026
Ausstellung „Pankows Partnerstadt Riwne – Persönliche Berichte vom Alltag im Krieg“ eröffnet am 9. Februar im Rathaus Pankow
Die Sonderausstellung „Pankows Partnerstadt Riwne – Persönliche Berichte vom Alltag im Krieg“ wird am Montag, dem 9. Februar 2026 um 19 Uhr im Rathaus Pankow eröffnet (Breite Str. 24a-26, 13187 Berlin, Foyer 2. Etage). Grußworte sprechen Bezirksbürgermeisterin Dr. Cordelia Koch und der Vorsitzende des Partnerschaftsverein Berlin Pankow – Riwne, Uwe Lehmann. Über die aktuelle Situation vor Ort berichtetdie Buchhändlerin Viktoriia Novytska, eine der Protagonistinnen des Projektes.
Die Ausstellung ist an zwei Orten zu sehen: vom 10. bis 20. Februar im Rathaus und vom 21. Februar bis 14. März 2026 im Rathaus-Center.
Zur Entstehung der Ausstellung
Im März 2025 besuchten Beschäftigte des Museums Pankow die westukrainische Partnerstadt. Bereits Ende 2022 hatten der Bezirk Pankow und Riwne eine Solidaritätspartnerschaft abgeschlossen, die am 12. Juli 2024 in eine offizielle Städtepartnerschaft mündete.
Während des Aufenthalts fanden zahlreiche Begegnungen und Besichtigungen statt. Dabei entstanden Interviews mit Einwohnerinnen und Einwohnern, die trotz der täglichen Bedrohung ihren Alltag gestalten und sich für die Stadtgesellschaft einsetzen – darunter Lehrerinnen, Krankenschwestern, der Zoodirektor, Vertreter der Zivilgesellschaft, Geschäftsleute, Historiker:innen, Museums- und Theaterleiter:innen sowie Vertreter der jüdischen Gemeinschaft.
Fotos und Interviews
Im Mittelpunkt der daraus entstandenen Schau stehen zwölf großformatige Fotoporträts der ukrainischen Fotografin Anna Mischuk sowie Filmproduktionen von Christian Betz. Die Porträtierten berichten von ihrem Alltag im Krieg. Neben einer Chronik der Stadtgeschichte bieten weitere Kurzfilme Einblicke in die Geschichte und Gegenwart Riwnes. Themen sind u.a. die deutsche Besatzung 1941 bis 1944, die Gedenkstätte Sosenki, ein Reisebericht und die Entwicklung der Städtepartnerschaft zwischen Pankow und Riwne.
Mit der Ausstellung möchte das Museum Pankow über die Geschichte der Partnerstadt informieren und für die aktuelle Situation der Bewohnerschaft seit dem russischen Angriffskrieg sensibilisieren: „Fernab abstrakter Frontberichte möchten wir mit der Ausstellung zeigen, wie Menschen in unserer Partnerstadt Riwne sich trotz der täglichen Bedrohung für die Stadtgesellschaft einsetzen“, sagt der Museumsleiter Bernt Roder.
Laufzeit: 10.02.2026 bis 20.02.2026
Öffnungszeiten: Montag bis Freitag 9.00–18.00 Uhr,
Ort: Rathaus Pankow, Foyer (2. OG), Breite Str. 24a-26, 13187 Berlin
Laufzeit: 21.02.2026 bis 14.03.2026
Öffnungszeiten: Montag bis Samstag, 11.00–13.00 u. 14.00-18 Uhr,
Ort: Rathaus-Center Pankow, 1. OG, Breite Str. 20, 13187 Berlin
Der Eintritt ist frei.
Weitere Infos:
https://www.berlin.de/museum-pankow/aktuelles/ausstellungen/sonderausstellungen/artikel.1634821.php
https://www.berlin.de/museum-pankow/aktuelles/
Partnerschaftsverein Berlin Pankow – Riwne: www.pankow-riwne.de/
leben / 29.01.2026
Positive Zwischenbilanz bei Umsetzung des Aktionsplans „Kinderfreundliche Kommune“
Über die bisherige Umsetzung des aktuellen Aktionsplans im Rahmen des Vorhabens „Kinderfreundliche Kommune“ haben sich jetzt Vertreter:innen verschiedener Fachämter und des Vereins Kinderfreundliche Kommunen e.V. sowie die drei sachverständigen Gutachter:innen im Rathaus Pankow ausgetauscht.
Meilensteine erreicht
Fast zwei Jahre nach der Verleihung des Siegels „Kinderfreundliche Kommune“ gaben die Sachverständigen Christa Böhme, Dominik Ringler und Claudia Kittel hilfreiche Anregungen und Hinweise zur weiteren Umsetzung des Aktionsplans. Grundlage bildete der im November eingereichte Zwischenbericht, in dem zu allen 38 Maßnahmen die Umsetzungsstände geschildert wurden. Zu zentralen Meilensteinen, die im Rahmen des Halbzeitgesprächs im Fokus standen, gehören die bis 2027 gesicherte Finanzierung des Kinder- und Jugendbüros „Mitbestimmen in Pankow“ sowie verschiedene ressortübergreifende Aktivitäten rund um die Prävention von Kinder- und Familienarmut. Besonders hervorzuheben ist die neue, mehrsprachige „Seite für junge Menschen“, die unter https://www.berlin.de/ba-pankow/junge_menschenzu finden ist. Während die bezirklichen Musikschulen mit neuen Beteiligungsaktionen und der Erstellung von Kinderschutzkonzepten die Umsetzung der UN-Kinderrechtskonvention erfolgreich angehen, dienen Pankows erfolgreich gestaltete Jugendorte im öffentlichen Raum bereits überregional als Vorbild für andere Kommunen.
Stärkung der Jugendhilfeleistungen
Zum übergeordneten Ziel, die Teilhabe und Lebensqualität für die junge Generation dauerhaft zu verbessern, gehört auch, Leistungen im Bereich der Jugendhilfe möglichst zu stärken. Das, so Bezirksbürgermeisterin Cordelia Koch, gestalte sich angesichts der derzeitigen Haushaltslage als große Herausforderung. Die Bezirksverwaltung nehme jedoch den Auftrag sehr ernst, in all ihren Handlungen die UN-Kinderrechte zu berücksichtigen und den Bezirk Pankow zu einer Kinderfreundlichen Kommune zu entwickeln.
Die Umsetzungsphase für den Aktionsplan Kinderfreundliche Kommune dauert drei Jahre und endet im April 2027. Es ist möglich, anschließend einen Aktionsplan für eine zweite Umsetzungsphase zu erstellen.
Der Berliner Bezirk Pankow trägt das Siegel „Kinderfreundliche Kommune“ seit April 2024 und gehört somit zu den deutschlandweit über 50 Kommunen, die ihre Politik und Verwaltung auf Kinderfreundlichkeit ausrichten wollen. Seit über zehn Jahren begleitet der Verein Kinderfreundliche Kommunen Städte und Gemeinden bei der lokalen Umsetzung der Kinderrechte. Das Vorhaben basiert auf den internationalen Erfahrungen aus der Child Friendly Cities Initiative von UNICEF.
Ansprechpartner:innen:
Bezirksamt Pankow, OE Sozialraumorientierte Planungskoordination, Koordinator:in Kinderfreundliche Kommunen: kinderfreundlich@ba-pankow.berlin.de
Kinderfreundliche Kommunen e.V., Geschäftsführer Dominik Bär, E-Mail info@kinderfreundliche-kommunen.de
leben / 28.01.2026
Prothesenwerkstatt für Riwne: Erfolgreiche Spendenkampagne wird 2026 fortgesetzt
Prothesenwerkstatt für Riwne: Erfolgreiche Spendenkampagne wird 2026 fortgesetzt
Das im letzten Jahr gestartete Projekt zur Einrichtung einer Prothesenwerkstatt in unserer ukrainischen Partnerstadt Riwne hat Ende 2025 einen wichtigen Meilenstein erreicht: Es wurden bereits Spenden in Höhe von 18.000 Euro gesammelt. Diese Summe entspricht der erforderlichen Eigenbeteiligung, die Voraussetzung für die Förderung des Projekts durch die Servicestelle Kommunen in der Einen Welt (SKEW) ist.
Pankows Partnerstadt erhält eine moderne Prothesenwerkstatt
Im Rahmen des Projekts wird im städtischen Krankenhaus von Riwne eine moderne Prothesenwerkstatt mit neuesten Geräten eingerichtet. In einer späteren Projektphase ist die Ausbildung von Prothesentechnikern vorgesehen, sodass in den ausgestatteten Räumlichkeiten künftig verletzte Soldaten und Zivilist:innen versorgt werden können.
Nächstes Spendenziel: 12.000 Euro
Um das Projekt weiter finanzieren zu können, wird auch in diesem Jahr zu weiteren Spenden aufgerufen. Für den Bau und die Installation der Werkstatt sowie für die Schulung des Personals werden weitere 12.000 Euro benötigt. Jede Spende – ob groß oder klein – trägt dazu bei, den Betroffenen eine Zukunft mit mehr Bewegungsfreiheit und Selbstständigkeit zu eröffnen.
Die Bezirksbürgermeisterin Dr. Cordelia Koch betont: „Es ist sehr erfreulich zu sehen, wie solidarisch die Pankower Bürgerinnen und Bürger sowie zahlreiche Organisationen – allen voran der Partnerschaftsverein Pankow-Riwne – mit unserer Partnerstadt sind. Mit dem Aufbau der Prothesenwerkstatt können wir ganz konkret helfen. Die Beschaffung der benötigten Ausrüstung kann nun beginnen. Herzlichen Dank für jede einzelne Spende!“
Spendenkonto:
Bezirkskasse Pankow
IBAN: DE06 1005 0000 4163 6100 01
Verwendungszweck (bitte unbedingt angeben): 253302324375 Prothesen-Projekt Riwne
Spendenbescheinigungen sind möglich. Die Überweisung einer Spende berechtigt nicht zu einer Gegenleistung.
Kontakt bei Fragen oder für weitere Informationen:
Daryna Illienko
Tel.: 030 90295-2624
E-Mail: Daryna.Illienko@ba-pankow.berlin.de
heilen / 26.01.2026
Das Helios Klinikum Berlin-Buch erhält Zertifizierung als Pankreaskrebszentrum

Berlin-Buch: Das Helios Klinikum Berlin-Buch ist erfolgreich als Pankreaskrebszentrum von der Deutschen Krebsgesellschaft (DKG) zertifiziert worden. Damit unterstreicht der größte Maximalversorger im Nord-Osten der Hauptstadt seinen Anspruch auf höchste Versorgungsqualität sowie ausgeprägte interdisziplinäre Expertise in der Diagnostik und Therapie von Erkrankungen der Bauchspeicheldrüse. Das Zertifizierte Pankreaskrebszentrum bündelt spezialisierte Kompetenzen aus allen relevanten Fachdisziplinen und bietet Patient:innen aus Berlin und der gesamten Region eine Behandlung auf höchstem medizinischem Niveau.
Die Deutsche Krebsgesellschaft (DKG) hat das Pankreaszentrum des Helios Klinikums Berlin- Buch als zertifiziertes Pankreaskrebszentrum anerkannt. Das Zentrum bündelt Kompetenzen aus den Fachdisziplinen der Allgemein-, Viszeral- und Onkologischen Chirurgie, Inneren Medizin und Gastroenterologie, Onkologie, Strahlentherapie und Radioonkologie, Diagnostischen und Interventionellen Radiologie sowie der Nuklearmedizin. „Die erfolgreiche Zertifizierung unseres Pankreaskrebszentrums ist ein wichtiger Meilenstein für den Standort Berlin-Buch. Sie unterstreicht nicht nur unsere medizinische Expertise, sondern auch unser stetes Bestreben, moderne Therapiekonzepte frühzeitig in die klinische Versorgung zu integrieren und damit die Behandlungsmöglichkeiten für unsere Patient:innen kontinuierlich weiterzuentwickeln“, betont Prof. Dr. med. Roger Wahba, Chefarzt der Allgemein-, Viszeral- und Onkologischen Chirurgie am Helios Klinikum Berlin-Buch.
Ein besonderer Schwerpunkt des neu zertifizierten Pankreaskrebszentrums liegt in der chirurgischen Versorgung. Hohe Fallzahlen, ausgewiesene onkologische Expertise und der Einsatz modernster Operationsverfahren gewährleisten eine exzellente Behandlungsqualität. Dazu zählt auch die robotergestützte Chirurgie, die hochpräzise und gleichzeitig besonders schonende Eingriffe ermöglicht und damit zu verbesserten postoperativen Ergebnissen sowie einer schnelleren Genesung beitragen kann.
Darüber hinaus eröffnet das Pankreaskrebszentrum neue therapeutische Perspektiven für Patient:innen mit lokal fortgeschrittenen, bislang inoperablen Tumoren. Erstmals kommt hier die Elektrochemotherapie zum Einsatz – ein innovatives Verfahren, bei dem gezielt gesetzte
elektrische Impulse die Aufnahme und Wirksamkeit von Chemotherapeutika im Tumorgewebe deutlich steigern.
Ein weiteres zukunftsweisendes High-Tech-Therapiekonzept befindet sich derzeit in Vorbereitung: die Brachytherapie mit endoskopisch eingebrachten radioaktiven Nanopartikeln. Ziel dieses Verfahrens ist es, lokal begrenzte Tumoren präzise von innen heraus zu behandeln und damit neue Möglichkeiten in der personalisierten Therapie von Pankreaskarzinomen zu eröffnen. Erkrankungen der Bauchspeicheldrüse – von gutartigen Veränderungen wie Zysten über akute und chronische Entzündungen (Pankreatitis) bis hin zu bösartigen Erkrankungen wie Pankreaskarzinomen oder neuroendokrinen Tumoren – erfordern ein hohes Maß an Expertise und eine enge interdisziplinäre Zusammenarbeit.
In der spezialisierten Pankreassprechstunde des Helios Klinikums Berlin-Buch werden Patient:innen von Ärzt:innen verschiedener Fachdisziplinen gemeinsam umfassend betreut. Die individuelle Therapieplanung erfolgt in mehrfach wöchentlich stattfindenden interdisziplinären Tumorkonferenzen. Modernste Operations- und Behandlungsmethoden, strukturierte Therapieabläufe sowie kurze diagnostische Wege gewährleisten ein Höchstmaß an Präzision und Sicherheit. Eine kontinuierliche endoskopische und radiologische Bereitschaft stellt zudem sicher, dass auch in Notfallsituationen rund um die Uhr jederzeit eine optimale Behandlungsmöglichkeit sichergestellt ist und Patient:innen optimal versorgt sind.
Mit der Zertifizierung des Pankreaskrebszentrums stärkt das Helios Klinikum Berlin-Buch seine Position als zentrale regionale Anlaufstelle für die Behandlung von Erkrankungen der Bauchspeicheldrüse und steht für eine innovative, qualitätsgesicherte Patientenversorgung auf höchstem Niveau.
Über das Helios Klinikum Berlin-Buch
Das Helios Klinikum Berlin-Buch ist ein modernes Krankenhaus der Maximalversorgung mit über 1.000 Betten in mehr als 60 Kliniken, Instituten und spezialisierten Zentren sowie einem Notfallzentrum mit Hubschrauberlandeplatz. Jährlich werden hier mehr als 55.000 stationäre und über 144.000 ambulante Patienten mit hohem medizinischem und pflegerischem Standard in Diagnostik und Therapie fachübergreifend behandelt, insbesondere in interdisziplinären Zentren wie z.B. im Brustzentrum, Darmzentrum, Hauttumorzentrum, Perinatalzentrum, der Stroke Unit und in der Chest Pain Unit. Die Klinik ist von der Deutschen Diabetes Gesellschaft als „Klinik für Diabetiker geeignet DDG“ zertifiziert.
Zudem ist die Gefäßmedizin in Berlin-Buch dreifach durch die Fachgesellschaften der DGG (Deutsche Gesellschaft für Gefäßchirurgie und Gefäßmedizin), der DGA (deutsche Gesellschaft für Angiologie) und der DEGIR (deutsche Gesellschaft für interventionelle Radiologie) als Gefäßzentrum zertifiziert.
Gelegen mitten in Berlin-Brandenburg, im grünen Nordosten Berlins in Pankow und in unmittelbarer Nähe zum Barnim, ist das Klinikum mit der S-Bahn (S 2) und Buslinie 893 oder per Auto (ca. 20 km vom Brandenburger Tor entfernt) direkt zu erreichen.
Helios gehört zum Gesundheitskonzern Fresenius und ist Europas führender privater Gesundheitsdienstleister mit rund 128.000 Mitarbeitenden. Zu Fresenius Helios gehören die Helios Gruppe in Deutschland sowie Quirónsalud in Spanien.
heilen / 26.01.2026
Mehr Sicherheit und Effizienz im OP
Digitales Narkoseprotokoll wird zum Standard im Helios Klinikum Berlin-Buch
Das Helios Klinikum Berlin-Buch geht einen weiteren Schritt in Richtung Digitalisierung: Mit der Einführung des digitalen Narkoseprotokolls verbessert sich die Qualität der medizinischen Dokumentation deutlich. Durch die automatisierte Erfassung vitaler Parameter und eine vereinfachte Dateneingabe per Mausklick oder über voreingestellte Standards wird der Dokumentationsaufwand für das anästhesiologische Team erheblich reduziert.
„Die digitale Narkosedokumentation ermöglicht uns eine präzisere und effizientere Erfassung aller relevanten Informationen während des Eingriffs. Das bedeutet nicht nur eine Zeitersparnis für unser Team, sondern auch eine höhere Patient:innensicherheit“, erklärt Dr. med. David Schwaiberger, Chefarzt Anästhesie, perioperative Medizin und Schmerztherapie im Helios Klinikum Berlin-Buch. „Wir können uns in kritischen Situationen vollständig auf unsere Patient:innen konzentrieren, ohne diese im Nachhinein aufwändig nachdokumentieren zu müssen. Außerdem stehen uns verbesserte Möglichkeiten zur Auswertung zur Verfügung, was ebenfalls positiv für die Patientensicherheit ist.“
Optimierte Prozesse
Im Gegensatz zu den bisherigen papierbasierten Protokollen bietet die digitale Lösung eine vollständige und verlustfreie Dokumentation. Vitalparameter, Laborwerte und Medikamentendosierungen werden automatisiert erfasst und direkt in das System integriert. Dies reduziert potenzielle Fehlerquellen und erleichtert die Nachverfolgbarkeit relevanter Daten. Auch die automatische Plausibilitätsprüfung trägt dazu bei, dass alle Eingaben korrekt und vollständig sind. „Das digitale System bietet uns jetzt eine nachhaltige, langfristig sicherere Lösung, die zugleich unsere interdisziplinäre Zusammenarbeit fördert“, ergänzt Dr. Schwaiberger.
Schnellere Versorgung
Neben der verbesserten Datensicherheit und Nachvollziehbarkeit profitieren auch die Patient:innen: Das digitale Narkoseprotokoll ermöglicht eine schnellere und gezieltere Versorgung im OP und reduziert gleichzeitig den administrativen Aufwand. Dies wirkt sich positiv auf die Zufriedenheit des Personals und der Patient:innen aus.
Das digitale Narkoseprotokoll im Helios Klinikum Berlin-Buch basiert auf einer Software, die mit verschiedenen Geräten kompatibel ist. Durch integrierte Schnittstellen können Daten aus Überwachungsmonitoren und Laboren nahtlos übernommen werden, was den klinischen Alltag weiter erleichtert. „Wir sind überzeugt, dass wir durch diese Digitalisierung nicht nur unsere internen Abläufe optimieren, sondern auch einen wertvollen Beitrag zur Qualitätssicherung in der Anästhesiologie leisten. Außerdem haben wir nun die Möglichkeit die Weiterbildungsinhalte zum Facharzt für Anästhesiologie unserer Ärzt:innen in Weiterbildung adäquat zu dokumentieren“, betont Dr. Schwaiberger abschließend. Auf der Intensiv- und der Intermediate Care Station in Berlin-Buch wird das System bereits seit mehreren Jahren erfolgreich eingesetzt.
leben, bilden / 23.01.2026
Neue Kultur im Quartier

Von Klangkunst bis Blindspot-Konzerte: Anna Petzer hat Leben in das leerstehende Festhaus des Ludwig Hoffmann Quartiers gebracht. Im Interview berichtet sie über Chancen, Vernetzung, Musikförderung und kulturelle Highlights für Buch
Sie engagieren sich als Künstlerin seit 2023 für die nachhaltige kulturelle Nutzung des Festhauses im Ludwig Hoffmann Quartier. Was ist das Besondere an diesem Ort?
Es ist ein Kulturhaus, das als solches konzeptionell mitbedacht wurde: Im Zentrum des Krankenhaus-Geländes wurde ein Gemeinschaftshaus gebaut, damit dort Ärzte, Mitarbeitende und Patienten zusammenkommen können. Es ist einerseits ein leerer Raum, der für mich per se spannend ist, weil er gestaltet werden kann und gleichzeitig ein Kulturraum, der mit Bühne, Tanzfläche und besonderer Akustik nach künstlerischer Belebung ruft. Und schließlich ist bemerkenswert, dass es in Buch zwar kulturelle Aktivitäten und Initiativen gibt, aber kein Kulturhaus. Für mich hieß das: Hier steht ein Kulturraum leer, und da gibt es meines Erachtens einen Bedarf – wie kann das zusammengebracht und der Ort wieder lebendig gestaltet werden?
Es gab andere Ideen für das Festhaus, die sich jedoch nicht umsetzen ließen. Der Eigentümer, Andreas Dahlke, hat mir die Chance gegeben, kulturelle Angebote zu schaffen, dafür Ansprechpartnerin zu sein und zu schauen, ob sich durch die Vermietung der Säle auch eine wirtschaftliche Perspektive für eine Kultureinrichtung aufbauen lässt.
Wie sind Sie an diese Aufgabe herangegangen?
Für mich waren drei Hauptaufgaben entscheidend: die Anbindung des Hauses an die Kunstszene Berlins, kulturelle Bildungsformate zu erproben und lokale Akteur:innen mit dem Ort zu vernetzen.
Im Frühjahr 2023 holte ich Regisseurin Nora Krahl mit Probenarbeiten für eine Virtual-Reality-Oper in den Saal. Um darüber hinaus ein Gefühl für das Haus und das Quartier zu entwickeln, setzte ich zusammen mit Kolleginnen eine erste eigene Veranstaltung, das Stimme-Voice-Festival, um. Etwa 40 Teilnehmende beschäftigten sich fünf Tage lang mit Gesang, Stimme und Atem – darunter auch Pädagog:innen aus Buch und Karow.
Die Akustik des Saales ist für mich als Musikerin reizvoll. Daher habe ich zum Tag des offenen Denkmals 2024 mit dem Klangkünstler Martin Supper eine künstlerische Intervention zu Klang und Architektur realisiert, die Besuchende einlud, die Ästhetik und das akustische Potential des Kulturdenkmals zu erleben.
Daneben war mir wichtig, den Raum für soziale Initiativen zu öffnen. Der Bucher Bürgerverein war hier mit den Bürgerforen. Hier fand die Kinder- und Jugendkonferenz des Bezirks statt. Der Verein „Kultur im Quartier“ erhielt die Möglichkeit, Räume des Festhauses für Lesungen, Flohmärkte und als Kulturtreffpunkt zu nutzen.
Parallel nahm ich in Bucher Netzwerkenteil, etwa in der Planungsraumkonferenz für Einrichtungen, die mit Kindern und Jugendlichen arbeiten. Hier hatte ich die Beteiligung an der Fête de la Musique angeregt, die 2024 erstmals in Buch stattfand.
Um die Kultur finanzieren zu können, habe ich neben der Vermietung viele Förderanträge gestellt, auch mit Partnern wie der Volkshochschule. Erfolgreich war jedoch einzig die Förderung der Blindspot-Konzerte durch die Musicboard Berlin GmbH.
Welchen Ansatz hatten diese Konzerte?
Die Konzertreihe war auf das Förderprogramm „Pop im Kiez“ angelegt. Blindspot-Konzerte, weil sie einen kulturell „blinden Fleck“ beleben. Um den Auftrittsort zu erproben, entstand ein breites Crossover-Programm.
Wir hatten zum Beispiel ein Streichquintett von renommierten klassischen Musikern da, die als „Wooden Elephant“ elektronische Alben auf analoge Instrumente übertragen. Sie spielten „Homogenic“ von Björk. Dann gab es Musik aus Lateinamerika von „Sonqo“ und „Los Pitutos“ sowie Folk und Jazz von Duo „Hjorton“, Singer-Song-Writerin „Oktober“ und Hauke Renken. „LouLou“ und „Panoptic“ verwoben Operngesang, Pop-Balladen und elektronische Musik. Und für eines der Konzerte konnte ich Hilde Kappes gewinnen, eine Ausnahmekünstlerin im Bereich der experimentellen Stimmkunst.
Welche Resonanz gab es auf die Konzerte?
In der Regel kamen rund 40 Leute. Beim Konzert von „Wooden Elephant“ war der Saal mit 100 Gästen so voll, dass es keine Stühle mehr gab. Bei weniger Publikum konnten wir durch Lichttechnik eine wohnzimmerartige Atmosphäre erzeugen. – Ich denke, insgesamt ist eine gute Wahrnehmung des Hauses entstanden, verknüpft mit Kunst und Kultur.
Wie hat die Vermietung der Säle funktioniert?
Wir haben die Räume für Events, als Drehort oder für private Feiern vermietet. Um ausreichend Einnahmen zu erzielen, müsste man sehr häufig vermieten. Immer würde etwas passieren, das mit dem Ort hier nichts zu tun hat, den Erwartungen an das Wohnquartier entgegenstünde und die Idee einer Kultureinrichtung auch nicht unterstützt. Gleichzeitig wurde die kulturelle Belebung von vielen Leuten geschätzt. Die Perspektive müsste, denke ich, eine reine Nutzung durch Kunst- und Kulturprogramm sein, welche aus dem Ort selbst wachsen darf.
Wie könnte die Zukunft als Kulturhaus gesichert werden?
Es bedürfte einer kulturpolitischen Agenda und Förderung, die es ermöglicht, Räume stabil aufzubauen und zu bespielen. Alles, was gerade wegbricht. Im Grunde müsste es jemanden geben, der diesen Kulturort in Trägerschaft mit einer kulturellen Vision übernimmt. Andreas Dahlke wäre dafür offen.
Interview: Christine Minkewitz/Campus Berlin-Buch GmbH
Das Interview erschien zuerst im Standortjournal buchinside 1/2026
21.01.2026
Kreislauffähige Verwaltung: Cradle to Cradle NGO übergibt Handlungspapier an Bezirksbürgermeisterin Dr. Cordelia Koch
Der Bezirk Berlin-Pankow will eine Vorreiterrolle in nachhaltiger Verwaltung und Kreislaufwirtschaft einnehmen. Dazu soll Cradle to Cradle (C2C) als ganzheitlicher kreislaufwirtschaftlicher Ansatz stärker in Verwaltungsprozesse integriert werden. Am 20. Januar 2026 wurde das Handlungspapier „Cradle to Cradle in Berlin-Pankow“ von Cradle to Cradle NGO an die Bezirksbürgermeisterin Dr. Cordelia Koch übergeben.
Das Handlungspapier bündelt erstmals praxisnahe Empfehlungen, die direkt an bestehende Strukturen und Prozesse der Bezirksverwaltung anknüpfen. Mit der Übergabe des Handlungspapiers setzt der Bezirk Pankow ein deutliches Zeichen: Die Transformation hin zu einer kreislauffähigen, zukunftsfähigen Verwaltung kann gelingen, wenn politische Beschlüsse, fachliche Expertise und die Erfahrung der Verwaltung zusammengeführt werden. Mit dem Handlungspapier liegt nun eine konkrete Grundlage vor, um bestehende Beschlüsse mit Leben zu füllen. Das Thema Kreislaufwirtschaft ist auch ein wichtiges Thema im Pankower Klimaschutzkonzept. So soll die Maßnahme „VW-09 Kreislauffähige Verwaltung“ das Thema im Bezirksamt verankern.
Entstehung und Hintergrund
Das Handlungspapier ist Ergebnis eines mehrjährigen Prozesses. Bereits 2021 beschloss die Bezirksverordnetenversammlung (BVV), Cradle to Cradle im Bezirk Berlin-Pankow schrittweise umzusetzen. Im selben Jahr trat Pankow dem kommunalen Netzwerk C2C Regionen bei. Im Jahr 2025 folgte eine gemeinsame Veranstaltungsreihe von Bezirksamt und Cradle to Cradle NGO. Mitarbeitende aus verschiedenen Fachämtern entwickelten dabei konkrete Ansätze für die Verwaltungspraxis. Die Workshops fanden überwiegend im C2C LAB in Berlin statt und bildeten die fachliche Grundlage für das nun vorliegende Handlungspapier.
Drei priorisierte Handlungsfelder
Aus den Ergebnissen der Veranstaltungsreihe leitet das Handlungspapier drei priorisierte Handlungsfelder ab:
● Bauen: Künftig sollten Bau- und Sanierungsprojekte stärker so geplant werden, dass eingesetzte Materialien gesund, rückbaubar und wiederverwendbar sind. Gebäude werden dabei als Materiallager verstanden.
● Beschaffung: Vorgeschlagen wird eine verbindliche Dienstanweisung, die klare Kriterien für die Beschaffung von Produkten und Dienstleistungen festlegt.
● Verwaltung: Empfohlen wird, C2C strategisch in bestehende ämterübergreifende Steuerungsrunden sowie in Weiterbildungsangebote für Mitarbeitende zu integrieren.
Warum Cradle to Cradle
Cradle to Cradle ist ein ganzheitlicher Ansatz, der über die klassische Kreislaufwirtschaft hinausgeht. Ziel ist nicht nur, Schäden zu reduzieren, sondern durch das Handeln positiv zu wirken und Mehrwert zu schaffen. Ziel ist ein positiver Fußabdruck. Produkte und Prozesse werden so gestaltet, dass kein Abfall entsteht, sondern Materialien in biologischen und technischen Kreisläufen zirkulieren. Eingesetzte Materialien sollen sowohl für Mensch als auch Umwelt gesund sein. Ökologische, wirtschaftliche und soziale Aspekte werden dabei gemeinsam gedacht. Dieser Ansatz soll der Komplexität einer kommunalen Verwaltung gerecht werden und Lösungsansätze für unterschiedliche Verwaltungsbereiche bieten.
Mehrwert für die Menschen im Bezirk
Die Umsetzung der vorgeschlagenen Maßnahmen wirkt sich direkt auf den Alltag der Bürger:innen aus. Gesündere Gebäude verbessern etwa das Raumklima. Öffentliche Mittel werden effizienter eingesetzt durch geringere Lebenszykluskosten. Zudem stärkt der Ansatz regionale Wertschöpfung und Innovation.
Kontakt:
Leitstelle Klimaschutz Angelika Haaser (Klimaschutzbeauftragte)
klimaschutz@ba-pankow.berlin.de
https://www.berlin.de/ba-pankow/politik-und-verwaltung/beauftragte/klimaschutz/artikel.1632779.php
leben / 21.01.2026
Kreislauffähige Verwaltung: Cradle to Cradle NGO übergibt Handlungspapier an Bezirksbürgermeisterin Dr. Cordelia Koch
Der Bezirk Berlin-Pankow will eine Vorreiterrolle in nachhaltiger Verwaltung und Kreislaufwirtschaft einnehmen. Dazu soll Cradle to Cradle (C2C) als ganzheitlicher kreislaufwirtschaftlicher Ansatz stärker in Verwaltungsprozesse integriert werden. Am 20. Januar 2026 wurde das Handlungspapier „Cradle to Cradle in Berlin-Pankow“ von Cradle to Cradle NGO an die Bezirksbürgermeisterin Dr. Cordelia Koch übergeben.
Das Handlungspapier bündelt erstmals praxisnahe Empfehlungen, die direkt an bestehende Strukturen und Prozesse der Bezirksverwaltung anknüpfen. Mit der Übergabe des Handlungspapiers setzt der Bezirk Pankow ein deutliches Zeichen: Die Transformation hin zu einer kreislauffähigen, zukunftsfähigen Verwaltung kann gelingen, wenn politische Beschlüsse, fachliche Expertise und die Erfahrung der Verwaltung zusammengeführt werden. Mit dem Handlungspapier liegt nun eine konkrete Grundlage vor, um bestehende Beschlüsse mit Leben zu füllen. Das Thema Kreislaufwirtschaft ist auch ein wichtiges Thema im Pankower Klimaschutzkonzept. So soll die Maßnahme „VW-09 Kreislauffähige Verwaltung“ das Thema im Bezirksamt verankern.
Entstehung und Hintergrund
Das Handlungspapier ist Ergebnis eines mehrjährigen Prozesses. Bereits 2021 beschloss die Bezirksverordnetenversammlung (BVV), Cradle to Cradle im Bezirk Berlin-Pankow schrittweise umzusetzen. Im selben Jahr trat Pankow dem kommunalen Netzwerk C2C Regionen bei. Im Jahr 2025 folgte eine gemeinsame Veranstaltungsreihe von Bezirksamt und Cradle to Cradle NGO. Mitarbeitende aus verschiedenen Fachämtern entwickelten dabei konkrete Ansätze für die Verwaltungspraxis. Die Workshops fanden überwiegend im C2C LAB in Berlin statt und bildeten die fachliche Grundlage für das nun vorliegende Handlungspapier.
Drei priorisierte Handlungsfelder
Aus den Ergebnissen der Veranstaltungsreihe leitet das Handlungspapier drei priorisierte Handlungsfelder ab:
● Bauen: Künftig sollten Bau- und Sanierungsprojekte stärker so geplant werden, dass eingesetzte Materialien gesund, rückbaubar und wiederverwendbar sind. Gebäude werden dabei als Materiallager verstanden.
● Beschaffung: Vorgeschlagen wird eine verbindliche Dienstanweisung, die klare Kriterien für die Beschaffung von Produkten und Dienstleistungen festlegt.
● Verwaltung: Empfohlen wird, C2C strategisch in bestehende ämterübergreifende Steuerungsrunden sowie in Weiterbildungsangebote für Mitarbeitende zu integrieren.
Warum Cradle to Cradle
Cradle to Cradle ist ein ganzheitlicher Ansatz, der über die klassische Kreislaufwirtschaft hinausgeht. Ziel ist nicht nur, Schäden zu reduzieren, sondern durch das Handeln positiv zu wirken und Mehrwert zu schaffen. Ziel ist ein positiver Fußabdruck. Produkte und Prozesse werden so gestaltet, dass kein Abfall entsteht, sondern Materialien in biologischen und technischen Kreisläufen zirkulieren. Eingesetzte Materialien sollen sowohl für Mensch als auch Umwelt gesund sein. Ökologische, wirtschaftliche und soziale Aspekte werden dabei gemeinsam gedacht. Dieser Ansatz soll der Komplexität einer kommunalen Verwaltung gerecht werden und Lösungsansätze für unterschiedliche Verwaltungsbereiche bieten.
Mehrwert für die Menschen im Bezirk
Die Umsetzung der vorgeschlagenen Maßnahmen wirkt sich direkt auf den Alltag der Bürger:innen aus. Gesündere Gebäude verbessern etwa das Raumklima. Öffentliche Mittel werden effizienter eingesetzt durch geringere Lebenszykluskosten. Zudem stärkt der Ansatz regionale Wertschöpfung und Innovation.
Kontakt:
Leitstelle Klimaschutz Angelika Haaser (Klimaschutzbeauftragte)
klimaschutz@ba-pankow.berlin.de
https://www.berlin.de/ba-pankow/politik-und-verwaltung/beauftragte/klimaschutz/artikel.1632779.php
produzieren / 14.01.2026
Proteomik neu gedacht

Das Start-up Absea Biotechnology GmbH entwickelt neue Technologien für die Proteomik. Interview mit Dr. Philip Lössl, Senior VP Science and Business Development
Was macht die Absea Biotechnology Group aus?
Absea Biotechnology entwickelt proteinwissenschaftliche Technologien, um die Proteomik voranzutreiben. Einer unserer Schwerpunkte ist es, monoklonale Antikörper für das gesamte humane Proteom zu entwickeln. Mit diesen Antikörpern lassen sich hochspezifisch molekulare Biomarker oder kranke Zellen nachweisen, zum Beispiel in Krebs oder Autoimmunerkrankungen. Zusammen mit unseren Schwesterfirmen in China und den USA verfügen wir weltweit über die größte Bibliothek rekombinant hergestellter menschlicher Proteine, die wir mithilfe unserer Hochdurchsatz-Proteinproduktionsplattform ständig vergrößern. Komplementär bauen wir in Berlin Massenspektrometrie-Pipelines auf, um das Zusammenspiel von Proteinen und Wirkstoffen besser zu verstehen.
Wir verstehen uns als Partner und Dienstleister in den Bereichen Proteomik, In-vitro-Diagnostik, Pharma- und Life-Science-Forschung.
Wie ist die Absea Biotechnology Group entstanden?
Den Grundstein hat die Immunologie-Professorin Wei Zhang gelegt. Während ihrer Promotion in Cambridge hat sie mit den Nobelpreisträgern César Milstein und Gregory Winter kooperiert, die die Grundlagen monoklonaler Antikörper erforscht haben. Nach Gründung ihrer ersten Antikörper-Firma arbeitete Wei Zhang eng mit dem Projekt „Human Protein Atlas“ zusammen. Später entwickelte sich eine noch deutlich größere Partnerschaft mit der schwedischen Firma Olink, nun Teil von ThermoFisher, für die Absea seither tausende von Protein-Antigenen und monoklonalen Antikörpern entwickelt hat. Um diesem proteomweiten Ansatz gerecht zu werden, wurde die Absea Group 2020 um den Bioinformatiker Tao Chen herum mit erweiterter Expertise neu aufgestellt. 2023 gründeten wir unser Berliner Start-up, das sich auf die massenspektrometrische Forschung und Entwicklung konzentriert.
Was ist das Geheimnis hinter Abseas großer Proteinbibliothek?
Tao Chen hat einen Machine Learning-basierten Algorithmus entwickelt, umProtein-Konstrukte zu designen. Sie entsprechen den natürlichen Sequenzen unseres Körpers, sind jedoch manchmal etwas kürzer. Dank des Algorithmus wissen wir genau, wie wir die Proteine kürzen müssen, um sie mit hoher Erfolgsrate sehr effizient und kostengünstig herzustellen.
Welche Innovationen verfolgen Sie?
Unsere Antikörper- und Proteinbibliotheken bilden das Proteom ab und unterstützen affinitätsbasierte Methoden. Darüber hinaus kann uns diese Schatzkiste an Molekülen helfen, massenspektrometrische Technologien noch einzigartiger zu machen – und „Making molecules“ mit „Mapping molecules“ zu komplementieren. Unsere wissenschaftlichen Berater Mikhail Savitski vom EMBL Heidelberg und Fan Liu vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP), beides führende Experten für massenspektrometrische Proteomik, haben uns darin bestärkt. Mit Matthias Mann vom MPI für Biochemie in Martinsried, dem meistzitierten Forscher Deutschlands und einem der Gründungsväter der Proteomik, haben wir einen Ansatz publiziert, unsere Proteine für klinische Tests mittels Massenspektrometrie zu nutzen.
Wie sieht dieser Ansatz aus?
Die Proteomik erlaubt meist nur eine relative Quantifizierung von Protein-Biomarkern: Ein Arzt könnte Ihnen zwar sagen, dass Sie mehr von dem Protein als letztes Mal im Blut haben, aber nicht genau, wieviel. Für die klinische Diagnostik ist deswegen eine absolute Biomarker-Quantifizierung wichtig. Bislang nutzte man dafür Peptide, die mit schweren Isotopen markiert sind. Diese Methode erlaubt nur den Teil des Protein-Biomarkers zu sehen und zu quantifizieren, der durch das Peptid abgedeckt ist. Wir haben daher angefangen, ganze Proteine isotopenmarkiert herzustellen. Das war bislang nicht in großem Maßstab möglich. Dank unserer jahrelangen Erfahrung in Proteinherstellung haben wir herausgefunden, wie man das macht.
Gibt man diese markierten Proteine in die Probe, sind sie dem Biomarker viel ähnlicher, weil beides Proteine sind. Im Gegensatz zu Peptiden können Proteine in der Probenvorbereitung mitlaufen. So wird kontrolliert, an welcher Stelle Veränderungen auftreten. In der Probenvorbereitung werden der Biomarker und das markierte Protein in Peptide gespalten. Auch bei den Peptiden findet sich dann das isotopenmarkierte Gegenstück. Das liefert sehr viele Datenpunkte, um den Biomarker zu quantifizieren. Stimmt die Korrelation mit dem markierten Gegenstück nicht, kann man in weiteren Massenspektrometrie-Messungen feststellen, was in dieser Region passiert ist.
Damit lassen sich parallel und hochsensitiv ganze Protein-Panels für eine bestimmte Erkrankung nach auffälligen Quantitäten untersuchen. Auf diesem Niveau könnten die Ergebnisse für die Klinik relevant sein.
Ein Weg in die Klinik wäre also möglich.
Das ist unsere Hoffnung. Auch die Plasma-Proteomik-Community schlägt diesen Ansatz vor. Wir arbeiten bereits mit einem europäischen Universitätsklinikum, aber noch befinden wir uns in der Forschungs- und Entwicklungsphase.
Wir haben jedoch noch mehr vor: Wir entwickeln eine Methodenplattform, um Protein-Protein und Protein-Wirkstoff-Interaktionen molekular besser abbilden zu können. Wir wollen diese Interaktionen direkt in intakten Zellen sowie Gewebs- und Zelllysaten analysieren. Das soll dazu dienen, Krankheiten, aber auch den Effekt von Wirkstoffen besser zu verstehen. Damit wollen wir langfristig unseren Partnern helfen, bessere Wirkstoffe zu entwickeln.
Wie würden Sie dabei vorgehen?
Im ersten Schritt geht es darum herauszufinden, ob ein Wirkstoff an das gewünschte Protein bindet und ob es noch weitere unerwartete, vielleicht sogar unerwünschte, Bindungspartner gibt. Hierfür verwenden wir eine massenspektrometrische Technologie, die uns für das gesamte Proteom zeigen kann, welche Proteinbereiche durch einen Wirkstoff blockiert werden. Darüber hinaus erfahren wir die genaue Bindestelle des Wirkstoffs. Das verrät uns zum Beispiel, ob der Wirkstoff das Protein inaktivieren oder Interaktionen mit anderen Proteinen verhindern kann.
Im zweiten Schritt geht es um die Protein-Protein-Interaktionen. Welche finden in behandelten oder unbehandelten Zelle statt, welche in gesunden oder kranken Zellen? Mittels Crosslinking-Massenspektrometrie erhalten wir ein Bild vom gesamten zellulären Netzwerk. Unsere Antikörper-Bibliotheken erlauben uns hier wiederum, in die Tiefe zu gehen: Wir können Crosslinking verwenden, um alle Protein-Protein-Kontakte in der Zelle zu fixieren. Anschließend lässt sich das Protein, an dem wir interessiert sind, mit einem unserer zahlreichen Antikörper anreichern und mit all seinen Interaktionspartner aus der Zelle herausziehen und analysieren.
Welche Kunden adressieren Sie damit?
Für Pharmakunden können wir bereits in der frühen Phase der Arzneimittelentwicklung krankheitsrelevante Proteintargets für Wirkstoffe identifizieren. Und indem wir zeigen, wie Wirkstoffe genau wirken, wird klarer, welche Kandidaten es sich lohnt weiterzuentwickeln.
Eine weitere Kundengruppe sind Protein-Biotechnologieunternehmen, die sich auf AI spezialisieren. Unsere umfassenden und qualitativ hochwertigen Datensätze mit tausenden von Interaktionen zwischen Proteinen sowie zwischen Proteinen und Wirkstoffen können für diese Unternehmen eine wertvolle Basis für die Entwicklung ihrer AI-Modelle sein.
Ab Januar ist Ihr Start-up im Gründerzentrum BerlinBioCube zu finden.
Wir freuen uns darauf, in einem Haus mit den anderen Start-ups zu sein, sich auszutauschen und auch gegenseitig zu unterstützen. Ich denke, dass das ein gutes Ökosystem für uns ist, um zu wachsen. Auf dem Campus haben wir bereits akademische Kooperationen mit dem FMP und dem Max Delbrück Center. Auch zu den Biotechfirmen bestehen gute Kontakte. Wir sehen hier am Standort noch viel Potenzial für gemeinsame Projekte.
Interview: Christine Minkewitz / CBB
Das Interview erschien zuerst im Standortjournal buchinside 1/2026.
leben / 14.01.2026
Für ein gewaltfreies Miteinander, gegen Antisemitismus und Rassismus – 27. Lichterkette anlässlich des 81. Jahrestages der Befreiung des KZ Auschwitz
Anlässlich des 81. Jahrestages der Befreiung des Konzentrationslagers Auschwitz findet am Dienstag, dem 27. Januar 2026 ab 18 Uhr die mittlerweile 27. Lichterkette in Pankow statt. Treffpunkt ist um 18 Uhr vor dem ehemaligen Jüdischen Waisenhaus Pankow, der heutigen Janusz-Korzcak-Bibliothek, in der Berliner Str. 120/121, 13187 Berlin. Es wird darum gebeten, eigene Kerzen mitzubringen.
Nach der Auftaktveranstaltung, die um 18 Uhr von Bezirksbürgermeisterin Cordelia Koch eröffnet wird, ziehen die Teilnehmenden mit Kerzen weiter zur Pankower Kirche. Auf dem Weg wird es einen Halt mit Redebeiträgen vor dem ehemaligen Gartenhaus von Josef Garbáty geben. Auf der Kreuzung Breite Str. / Berliner Str. wird der Verkehr für eine Gedenkminute unterbrochen. Anschließend findet in der Kirche Alt-Pankow eine Gedenkveranstaltung mit Pankower Chören statt.
Holocaust-Gedenktag am 27. Januar
Der 27. Januar ist seit 1996 offizieller Gedenktag in der Bundesrepublik Deutschland. Seit 1999 gestalten Engagierte in Pankow eine Lichterkette, um an die Befreiung von Auschwitz durch die sowjetischen Soldaten zu erinnern. In diesem Jahr jährt sich die Befreiung schon zum 81. Mal.
Die Kommission für Bürgerarbeit gibt gemeinsam mit der Evangelischen Kirchengemeinde Alt-Pankow und der Kreisvereinigung Pankow der Verfolgten des Naziregimes – Bund der Antifaschistinnen und Antifaschisten (VVN-BdA) am Tag des Gedenkens an die Opfer des Holocaust dem Erinnern einen Ort, einen Raum und eine Gestalt mit der nunmehr 27. Lichterkette.
Es geht den Veranstaltenden nicht nur um das Gedenken für die ermordeten jüdischen Menschen und die vielen anderen Opfer. Sie wollen auch verdeutlichen, dass die Herausforderungen offensichtlich wachsen. Auch deshalb soll mit der Veranstaltung ein Beitrag für das Zusammenleben in gegenseitiger Akzeptanz geleistet werden – unabhängig von Herkunft, Religion und Lebenseinstellung. Alle Interessierten sind dazu aufgerufen, sich vor dem Hintergrund eines zunehmenden Rassismus, des anwachsenden Antisemitismus und Nationalismus mit ihrer Teilnahme an der Gedenkveranstaltung für ein solidarisches Miteinander im Bezirk zu engagieren. Im Sinne des Gedenkens wird darum gebeten, auf nationale Symbole und Parteifahnen zu verzichten.
Weitere Informationen: https://lichterkette-pankow.de/
Pressekontakt:
Jutta Kayser, Tel. 030 – 47 54 06 42, info@lichterkette-pankow.de
leben / 13.01.2026
3. Pankower Gastronomiegipfel am 22. Januar in der WABE rückt Außengastronomie in den Fokus
Das Bezirksamt Pankow lädt am 22. Januar 2026 von 13:00 bis 15:00 Uhr zum 3. Pankower Gastronomiegipfel in die WABEin der Danziger Straße 101, 10405 Berlin ein. Unter dem Titel „Mehr Vielfalt, mehr Verantwortung: Gastronomie als Motor der Stadt“ steht die Außengastronomie im Mittelpunkt der Veranstaltung.
Für das Bezirksamt Pankow ist die Gastronomie ein zentraler Treiber urbaner Lebendigkeit: Sie schafft Begegnungsräume, steigert die Aufenthaltsqualität und setzt wirtschaftliche Impulse. Gleichzeitig kommt es insbesondere im Zusammenhang mit Außengastronomie immer wieder zu Nutzungskonflikten, etwa durch Lärm oder unterschiedliche Erwartungen von Anwohnenden und Betrieben.
Herausforderungen und Lösungsansätze für die Außengastronomie im Fokus
Vor dem Hintergrund des Schankvorgartenkonflikts um das Café „SchwarzSauer“ im Jahr 2025 widmet sich der diesjährige Gastronomiegipfel den Herausforderungen und Lösungsansätzen für die Außengastronomie in urbanen Lagen. Beim nunmehr dritten Dialogforum für die Branche sollen Gastronominnen und Gastronomen erneut ihre Perspektiven einbringen und eigene Anliegen formulieren. Ziel ist es, den Austausch zwischen Gastronomie, Verwaltung und Nachbarschaft weiter zu vertiefen.
Nach der Eröffnung durch die Bezirksbürgermeisterin Dr. Cordelia Koch um 13:00 Uhr folgt eine Podiumsdiskussion zum Thema „Aktueller Rahmen für die Außengastronomie – Lösungen und Perspektiven“. Die Diskussion wird moderiert von Philip Ibrahim, Vizepräsident des DEHOGA Berlin. Auf dem Podium diskutieren Dr. Cordelia Koch, Rechtsanwalt Tjarde Elix, die Gastronomen Verda Sindiran und Thorsten Sowade sowie Max E. Neumann vom Tourismusverein Berlin-Pankow e. V.
Ziel des 3. Pankower Gastronomiegipfels ist es, das gegenseitige Verständnis für die unterschiedlichen Interessen von Gastronomie, Verwaltung und Nachbarschaft zu stärken. Darüber hinaus sollen konkrete Ideen und Ansatzpunkte für nachbarschaftsverträgliche Lösungen in den urbanen Gebieten des Bezirks gesammelt werden. Der Gipfel versteht sich als Auftakt für einen konstruktiven Austausch und als Beginn eines gemeinsamen Lern- und Verständigungsprozesses.
Um Anmeldung per E-Mail an info.wirtschaft@ba-pankow.berlin.de wird gebeten.
leben / 13.01.2026
Kaffeewette 2026: Pankow sammelt bis 5. Februar Kaffee und unterstützt die Kältehilfe
Die vom Reinickendorfer Einzelhändler Michael Lind initiierte Kaffeewette gegen die Kälte startet am 19. Januar in eine neue Runde. Erstmals werden dann fast alle Berliner Bezirke dabei sein. Alle Interessierten sind aufgerufen, bis Donnerstag, den 5. Februar 2026, Kaffee für die Kältehilfe zu spenden. Mit dem Ziel möglichst viel Kaffee für die Einrichtungen der Kältehilfe in ihren Bezirken zu sammeln, damit eine große Geldspende obendrauf kommt: Denn jeder Bezirk, der es schafft, mindestens 500 Kaffeepäckchen zu sammeln, erhält von Herrn Michael Lind oder seinen Aktionspartnern Ralf Oelmann, Hasan Ilter und Mike Baer je 2.500 Euro zusätzlich für die Kältehilfe im jeweiligen Bezirk. Und am Ende steht natürlich auch die Challenge: Welcher Bezirk schafft es, den meisten Kaffee für die Kältehilfe zu sammeln?
Vier Bürgerämter als Sammelstellen
Das Bezirksamt Pankow hat dazu Sammelstellen in den vier Bürgerämtern eingerichtet. Die Kaffeespenden können vom 19. Januar bis 5. Februar zu den regulären Öffnungszeiten (Mo. 8 – 16, Di. Do. 9.30 – 18, Mi. 8 – 14, Fr. 8 – 13 Uhr) jeweils in den Zimmern der Leitung abgegeben werden:
- Bürgeramt Weißensee, Berliner Allee 252-260, 13088 Berlin, Raum 160
- Bürgeramt Buch, Franz-Schmidt-Straße 8-10, 13125 Berlin, am Infotresen
- Bürgeramt Prenzlauer Berg, Fröbelstraße 17, Haus 6, am Platz 9
- Bürgeramt Pankow, Breite Straße 24A-26, 13187 Berlin, Raum EG 06
Dazu erklärt Bezirksbürgermeisterin Dr. Cordelia Koch: „Ich finde es toll, dass wir dieses Jahr auch mit dabei sind und setze auf die Spendenbereitschaft und Nächstenliebe der Pankower Bevölkerung. Als einwohnerstärkster Bezirk sollten wir einen respektablen Beitrag leisten können. Ich rufe die Pankowerinnen und Pankower auf, die Aktion durch zahlreiche Spenden zu unterstützen und bedanke mich herzlich für die Bereitschaft dazu.“
Ergebnispräsentation am 9. Februar 2026
Vor einem Jahr hatten die Reinickendorfer 3051 Päckchen gesammelt und damit die Challenge gewonnen. Als Titelverteidiger lädt das Bezirksamt Reinickendorf Berlins Bezirksbürgermeisterinnen und Bezirksbürgermeister zum offiziellen Abschluss der Kaffeewette am Montag, dem 9. Februar 2026 um 12.00 Uhr in das Foyer des Ernst-Reuter-Saales im Rathaus ein.
Michael Lind: „In einer von vielen als hilflos beschriebenen Zeit muss man anpacken, einfach machen, was im Kleinen bewirken, damit Großes in Gang kommt. Und manchmal ist es eben eine heiße Tasse Kaffee aus der Kaffeewette, eine freundliche Geste, die zu einem stabilen Hilfsangebot von Vereinen und sozialen Diensten in den Kiezen hinführt.“
Regeln:
- Es werden ausschließlich Kaffeepäckchen (Kaffeepulver und Kaffeebohnen) für das Endergebnis berücksichtigt. Kaffeekapseln gelten nicht.
- Anderweitige Spenden wie etwa Tee, Kakao, Milch, Zucker u.ä. werden der Kältehilfe zugeleitet, ohne aber gezählt zu werden.
- Da in der Öffentlichkeit das 500-Gramm-Paket als das gängigste Format gilt, werden je 500 Gramm als ein Paket gezählt. Das heißt: z.B. 100 kg entsprechen 200 Päckchen, die gewertet werden.
Die Berliner Kältehilfe bietet täglich wohnungslosen Menschen einen sicheren Schlafplatz, warme Mahlzeiten, Kleidung, Hygienemöglichkeiten sowie ein Beratungsangebot. Insbesondere in den Wintermonaten werden dadurch Leben gerettet. In der Hauptstadt leben etwa 40.000 Menschen ohne Wohnung. Hier leistet die Kältehilfe der Berliner Stadtmission einen unschätzbaren Dienst.
forschen / 09.01.2026
Doppelter Angriff auf entartete B-Zellen
Das Multiple Myelom, eine Krebserkrankung des Knochenmarks, ist trotz moderner CAR-T-Zelltherapien schwer zu behandeln. Ein Team um Armin Rehm stellt in „Molecular Therapy“ eine verbesserte Immuntherapie vor, die die entarteten Zellen gleich an zwei Merkmalen erkennt und vernichtet.
Ein Multiples Myelom ist eine unheilvolle Diagnose. Meist nimmt die Krankheit im Knochenmark ihren Lauf. Reife B-Zellen, Plasmazellen genannt, fangen dort an, sich unkontrolliert zu vermehren und zu viele, teilweise fehlerhafte Antikörper herzustellen. Heilbar ist die Krebserkrankung, die unter anderem die Knochensubstanz zerstört und dann sehr schmerzhaft sein kann, bislang nicht.
Moderne CAR-T-Zelltherapien können seit einigen Jahren das Leben vieler Myelom-Patient*innen zwar deutlich verlängern, doch auch sie haben Schwächen. „Bei manchen Betroffenen schlägt die Behandlung gar nicht an. Bei anderen kommt es früher oder später zu Rückfällen, die dann oft schnell zum Tode führen“, erklärt Dr. Armin Rehm, der Leiter der Arbeitsgruppe „Translationale Tumorimmunologie“ am Max Delbrück Center.
Im Fachblatt „Molecular Therapy“ stellt der Berliner Forscher jetzt gemeinsam mit PD Dr. Uta Elisabeth Höpken, der Leiterin der Arbeitsgruppe „Mikroumgebung als Regulator bei Autoimmunität und Krebs“ am Max Delbrück Center, sowie einem internationalen Team eine optimierte Immuntherapie vor: Die CAR-T-Zellen, die Rehm und seine Kolleg*innen im Labor hergestellt haben, erkennen die entarteten B-Zellen nicht wie bisher anhand nur eines Oberflächenmerkmals. Stattdessen nutzen sie gleich zwei solcher Rezeptoren, an denen sie andocken und die Krebszellen dadurch vernichten können.
Nicht alle Erkrankten besitzen den BCMA-Rezeptor
Lange Zeit wurde das Multiple Myelom ausschließlich mit Chemo- und Antikörpertherapien behandelt, manchmal ergänzt von Transplantationen körpereigener Blutstammzellen. Die Heilungsaussichten blieben mit diesen Ansätzen jedoch gering. Erst die seit einigen Jahren für verschiedene Krebsarten zugelassenen CAR-T-Zelltherapien brachten den Myelom-Patient*innen neue Hoffnung.
Bei der Behandlung entnimmt man den Erkrankten T-Zellen und rüstet sie in einem Bioreaktor mit der genetischen Information für einen Chimären Antigen-Rezeptor, den CAR, aus. Die CARs dienen den Immunzellen als Sensoren, um – im Fall des Multiplen Myeloms – das Oberflächenprotein BCMA aufzuspüren, das fast nur auf Plasmazellen, nicht aber auf gewöhnlichen B-Zellen zu finden ist. Die genetisch veränderten T-Zellen werden den Patient*innen per Transfusion wieder verabreicht, sodass sie die Krebszellen im Körper aufspüren und zerstören können.
„Das Protein BCMA ist allerdings nicht auf allen entarteten Plasmazellen vorhanden“, sagt Rehm. Bei einigen Patient*innen mit einem Multiplen Myelom sei es gar nicht nachweisbar, bei anderen gehe es im Laufe der Therapie verloren. „Wir haben daher drei Methoden kombiniert, die Einzelzell-RNA-Sequenzierung, die Immunhistochemie und die Durchflusszytometrie, und so nach einer weiteren Oberflächenstruktur gesucht, die für entartete B-Zellen typisch ist. Diese haben wir mit BAFF-R gefunden“, sagt die Erstautorin der Studie, Dr. Agnese Fiori aus Rehms Team, die inzwischen an der Charité – Universitätsmedizin Berlin forscht.
Zur Prävention und Therapie von Rezidiven
Auch zwei weitere Forscher der Charité waren an der Publikation maßgeblich beteiligt: Professor Jörg Westermann von der Medizinischen Klinik mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie sowie Professor Jan Krönke, der mittlerweile die Klinik für Innere Medizin C – Hämatologie, Onkologie, Stammzelltransplantation und Palliativmedizin der Universitätsmedizin Greifswald leitet.
„BAFF-R ist insbesondere auf Zellen von Rezidiven des Multiplen Myeloms vermehrt vorhanden“, sagt Fiori. Darüber hinaus finde man es häufig auf entarteten Plasmazellen ohne BCMA, denen die bislang übliche Behandlung nichts anhaben kann. „Therapeutisch ist es somit in zweierlei Hinsicht naheliegend, CAR-T-Zellen zu verwenden, die sowohl BCMA als auch BAFF-R erkennen“, erläutert Rehm.
Der Forscher geht davon aus, dass etwa 5 bis 30 Prozent aller Patient*innen mit einem Multiplen Myelom von dem doppelten Ansatz profitieren würden. Für eine personalisierte Therapie sei es entscheidend, diese Erkrankten schon vor Behandlungsbeginn mit einem entsprechenden Test zu identifizieren, sagt er. Ein solches Screening sei in der klinischen Praxis leicht umsetzbar.
Erfolge in Experimenten mit Krebszellen
Gemeinsam mit seinem Team hat Rehm die bispezifischen CAR-T-Zellen sowohl in Zelllinien des Multiplen Myeloms als auch in patient*inneneigenen Zellen des Knochenmarks getestet. „In all unseren Experimenten konnten wir zeigen, dass die verbesserten CAR-T-Zellen auch dann weiter wirksam sind, wenn der BCMA-Rezeptor fehlt oder therapiebedingt verloren gegangen ist – also selbst dann, wenn eine Behandlung mit monospezifischen CAR-T-Zellen versagt hat“, berichtet der Wissenschaftler. Er hoffe daher, dass der neue Ansatz die Entstehung vieler Rezidive verhindern könne und den Betroffenen mehr Lebenszeit schenke, vielleicht sogar eine Heilung ermögliche.
„Um das Potenzial unserer Methode wirklich gut einschätzen zu können, ist nun eine erste klinische Studie notwendig“, fügt Rehm hinzu. Gemeinsam mit Kolleg*innen des Nationalen Centrums für Tumorerkrankungen (NCT) – einer langfristig angelegten Kooperation zwischen dem Deutschen Krebsforschungszentrum (DKFZ), exzellenten Partnern in der Universitätsmedizin und weiteren herausragenden Forschungspartnern an verschiedenen Standorten in Deutschland, zu der in Berlin neben dem Max Delbrück Center auch die Charité und das Berlin Institute of Health (BIH) gehören – möchte er sich im nächsten Schritt um entsprechende Fördergelder kümmern. Ziel des Forschers ist es, dass möglichst bald die ersten Patient*innen von den optimierten CAR-T-Zellen profitieren.
Foto: Histologische Aufnahme eines Multiplen Myeloms im Knochenmark: Die entarteten Plasmazellen sind violett angefärbt und es ist zu sehen, dass sie die gesunden Zellen fast vollständig verdrängt haben. Die großen weißen Hohlräume sind Artefakte, die durch die Fixierung der Gewebeprobe entstanden sind. © Ioannis Anagnostopoulos, Institut für Pathologie, Universität Würzburg
Max Delbrück Center
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft legt mit seinen Entdeckungen von heute den Grundstein für die Medizin von morgen. An den Standorten in Berlin-Buch, Berlin-Mitte, Heidelberg und Mannheim arbeiten unsere Forschenden interdisziplinär zusammen, um die Komplexität unterschiedlicher Krankheiten auf Systemebene zu entschlüsseln – von Molekülen und Zellen über Organe bis hin zum gesamten Organismus. In wissenschaftlichen, klinischen und industriellen Partnerschaften sowie in globalen Netzwerken arbeiten wir gemeinsam daran, biologische Erkenntnisse in praxisnahe Anwendungen zu überführen – mit dem Ziel, Frühindikatoren für Krankheiten zu identifizieren, personalisierte Behandlungen zu entwickeln und letztlich Krankheiten vorzubeugen. Das Max Delbrück Center wurde 1992 gegründet und vereint heute eine vielfältige Belegschaft mit rund 1.800 Menschen aus mehr als 70 Ländern. Wir werden zu 90 Prozent durch den Bund und zu 10 Prozent durch das Land Berlin finanziert.
Pressemitteilung auf der Webseite des Max Delbrück Center
Doppelter Angriff auf entartete B-Zellen
leben, bilden / 09.01.2026
Gute Vorsätze leicht umgesetzt – Die Angebote der VHS Pankow im Jahr 2026
Die Umfrage in Deutschland zu den beliebtesten guten Vorsätzen für das Jahr 2026 hat ergeben, dass von den Befragten 52% mehr Geld sparen möchten, 50% sich gesünder ernähren wollen, 48% mehr Sport treiben möchten, 37% abnehmen wollen und
35% mehr Zeit mit der Familie oder Freunden verbringen möchten. (Quelle: Statistisches Bundesamt)
Breites Themenspektrum im Programm der Volkshochschule Pankow
Bei einigen guten Vorsätzen hilft die VHS Pankow mit vielfältigen Angeboten, z. B. bei den Themen Psyche, Karriere und Persönlichkeit, Gesundheit und Wohlbefinden. So gibt es kostenfreie Online-Vorträge wie „Schluss mit Aufschieben“ und „Gewaltfreie Kommunikation 3.0“. Ebenso kostenfrei oder mit geringem Obolus sind Stadtführungen, PC-Sprechstunden und Gesundheitsvorträge, wie „Der Männerweg zur Gesundheit“ oder „Nahrungsergänzungsmittel – Durchblick im Pillen-Dschungel“. Praktischer kann es dann im Kochkurs werden, wenn es gilt, entzündungshemmend zu kochen oder nachhaltig zu genießen.
Wer lieber eine neue Sprache erlernen möchte, kann aus mehr als 40 Möglichkeiten schöpfen oder einfach mal eine (Minderheiten-)Sprache an einem Abend kennenlernen. Für eine verständlichere Kommunikation kann u. a. der Kurs „Einführung in die Leichte Sprache“ von Vorteil sein.
Raus aus dem Sessel, rein in das Bewegungsvergnügen heißt es im Gesundheitsbereich, wo aktuell 385 Kurse von Aikido bis Zumba® offeriert werden – für Jung und Alt. Für alle, die etwas für ihre Entspannung und Resilienz tun möchten, ist das Angebot eben so umfangreich wie speziell – inklusive Bildungszeitkurse für Arbeitnehmer:innen.
Über 3.000 Kurse, offen für viele Altersgruppen
Das Spektrum ist breit und steht prinzipiell allen Menschen ab 16 Jahre offen. Auch für Kinder und Familien gibt es Angebote. 480 Kursleitende bieten durch das Jahr hindurch über 3.000 Kurse an. Unter professioneller Anleitung wird entdeckt und diskutiert, trainiert und entspannt, gelacht und gestaunt.
Infos und persönliche Beratung am 14. Januar im Rathaus-Center
Am Mittwoch, den 14. Januar präsentiert die VHS Pankow ihr Frühjahrsprogramm im Rathaus-Center Pankow, Breite Str. 20, 13187 Berlin. Dort kann man sich von 10 bis 18 Uhr umfassend beraten lassen und ein Programmheft-Magazin erhalten.
Alle Informationen zu Kursen, Standorten und Services sind online unter www.vhspankow.de zu finden.
forschen / 08.01.2026
Eine Chance für den Standort Berlin

Das Einstein Center for Early Disease Interception wird ab Januar 2026 mit sechs Millionen Euro gefördert. Im Interview erläutern Nikolaus Rajewsky und Leif Erik Sander aus dem Sprecherteam, warum neue Technologien und institutionenübergreifende Zusammenarbeit die Prävention der Zukunft ermöglichen.
Das neue Einstein Center trägt „Early Disease Interception“ im Namen. Was bedeutet das konkret?
Professor Nikolaus Rajewsky: Krankhafte Prozesse im Gewebe verlaufen oft über Jahre unbemerkt, bis Symptome auftreten. Zu diesem Zeitpunkt ist der Schaden meist erheblich und nur begrenzt rückgängig zu machen. Viel besser wäre es, sehr viel früher einzugreifen, in einem Stadium, in dem nur einzelne Zellen betroffen sind und die Krankheit noch steuerbar ist.
Dank großer technologischer Fortschritte verfügen wir heute gewissermaßen über ein molekulares Supermikroskop. Wir können Krankheitsprozesse in subzellulärer Auflösung sichtbar machen – in Geweben, in Körperflüssigkeiten, sogar in der Luft, die wir ausatmen. Künstliche Intelligenz und maschinelles Lernen helfen uns dabei, die enormen Datenmengen zu bändigen und Krankheitsverläufe vorherzusagen.
Wir wollen die frühesten Mechanismen verstehen, die die Zellen vom gesunden Gleichgewicht in Richtung Krankheit treiben und steuern, welchen Weg diese Zellen einschlagen – das meinen wir mit „Interception“. Solche gezielten Eingriffe, bevor Schäden entstehen, können wir inzwischen realistisch testen, zum Beispiel mithilfe von Organoiden, also miniaturisierten Organmodellen.
Herr Sander, wie würden Sie diesen Ansatz Ihren Patient*innen erklären?
Professor Leif Erik Sander: Im Kern geht es um sehr präzise Prävention. Für die Patientinnen und Patienten zählt, dass ihre Lebensqualität und ihre Organfunktionen erhalten bleiben – selbst wenn auf zellulärer Ebene bereits krankhafte Veränderungen beginnen.
In der Krebsfrüherkennung gibt es solche Ansätze bereits mit eher herkömmlichen Methoden. Bei vielen anderen Krankheiten kommen wir bislang zu spät. Wenn in der Neurologie eine Demenz diagnostiziert wird, können wir nur das Fortschreiten der Erkrankung verlangsamen. Ähnlich ist es bei bestimmten Lungenkrankheiten, die zu einer fortschreitenden Vernarbung des Gewebes führen und teils dramatisch verlaufen.
Herkömmliche Methoden können die Vorzeichen solcher sich anbahnender Erkrankungen nicht erfassen – und wir verstehen auch gar nicht immer, was eigentlich schiefläuft und wie man kausal eingreifen könnte. Hier setzt „Early Disease Interception“ an: Wir wollen wissen, was die Weichen falsch stellt und Möglichkeiten schaffen, diese Weichen sehr früh wieder umzustellen. Der Zug soll quasi wieder aufs gesunde Gleis.
Wie genau funktioniert das Supermikroskop?
Nikolaus Rajewsky: Wir können heute sehr genau analysieren, welche Zellen im Gewebe zu welchem Zeitpunkt auf welche Informationen ihres Genoms zugreifen – oder eben nicht. In einem einzigen histologischen Schnitt befinden sich etwa 100.000 Zellen mit jeweils etwa 20.000 Genen. Entsprechend groß sind die entstehenden Datenmengen. Anhand dieser Daten können wir krankheitsrelevante Signalwege und komplexe metabolische Netzwerke rekonstruieren. Der entscheidende Fortschritt besteht darin, dass wir Krankheit so nicht nur beschreiben, sondern sie kausal verstehen. Das ist die Voraussetzung dafür, gezielt und frühzeitig einzugreifen.
Was sind die größten Hürden auf dem Weg in die klinische Anwendung?
Leif Erik Sander: Diese extrem hochauflösenden Methoden liefern uns genau die Informationen, die wir zur Unterscheidung der frühen Krankheitsprozesse brauchen. Die Methoden dienen zunächst der Forschung und sind mitunter sehr teuer. Der entscheidende nächste Schritt besteht darin, die Komplexität auf wenige Dimensionen zu reduzieren und robuste, vereinfachte Tests zu entwickeln, die sich für viele Menschen eignen.
Eine Schlüsselrolle spielt die Künstliche Intelligenz. Wir wollen sie nutzen, um molekulare Daten mit klinischen Routinedaten zu verknüpfen, Muster zu erkennen und gezielt individuelle Erkrankungsrisiken vorherzusagen.
Das Einstein Center wird sechs Jahre gefördert. Was erwarten Sie in dieser Zeit?
Nikolaus Rajewsky: Was hier in Berlin entsteht, geht über einzelne Projekte hinaus. Wir treiben gemeinsam eine neue Form der molekularen Prävention voran. Das Konzept haben wir im europäischen LifeTime-Konsortium entwickelt und 2020 in Nature beschrieben. Hunderte Wissenschaftler*innen aus ganz Europa waren dabei, wir sind also international hervorragend vernetzt.
Mit dem Berliner Exzellenzcluster ImmunoPreCept gibt es eine starke Ergänzung in der Immunologie. Neu am Einstein Center ist die strukturierte, institutionenübergreifende Zusammenarbeit, um neue Wege in die Anwendung zu finden. Kliniker*innen, Grundlagenforscher*innen und Datenwissenschaftler*innen arbeiten mit ihrer jeweiligen Expertise systematisch zusammen und nicht nebeneinander.
Große Fortschritte entstehen weder allein in der Klinik noch ausschließlich im Labor oder am Computer. Das Einstein Center schafft eine gemeinsame Plattform mit klaren Regeln, kurzen Wegen und ohne unnötige bürokratische Hürden. Das ist absolut essenziell, denn komplexe Kooperationen scheitern sonst oft schon, bevor sie beginnen.
In der zweijährigen Vorbereitungsphase für das Einstein Center haben wir uns international nach Vorbildern umgesehen: In Lausanne gibt es eine interessante Konstruktion. Dann das Broad Institute in Boston, wo sich Harvard, MIT und andere zusammengetan haben. Wir wollen in Berlin schrittweise ein offenes Netzwerk schaffen, in dem die Grundregeln für alle Interessierten festgelegt sind und man deshalb schneller ist. Das Thema molekulare Prävention hat man übrigens auch andernorts in Deutschland und international im Blick.
Ist Berlin gut positioniert?
Leif Erik Sander: Wir haben landeseigene Universitäten, die auf sehr hohem Niveau ausbilden. Wir haben mit der Charité die größte Universitätsklinik Europas sowie eine sehr hohe Dichte außeruniversitärer Forschungsinstitutionen, wo wirklich die besten Köpfe mit modernsten Technologien arbeiten. Sie bringen die Expertise ein, die man für so ein komplexes und zukunftsträchtiges Thema braucht. In dieser Mischung liegt für mich der Wettbewerbsvorteil Berlins. Da entsteht schnell echter Mehrwert.
Für die hochqualifizierten jungen Talente in Berlin spielen institutionelle Grenzen kaum eine Rolle. Sie haben tolle Ideen und wollen Technologien der verschiedenen Einrichtungen frei nutzen, um neue Entdeckungen zu machen. Deswegen kommen sie hierher. Das Einstein Center bietet dafür einen strukturellen Rahmen. Natürlich entsteht hier nicht in ein paar Jahren das nächste Broad Institute. Aber etwas, das von einem ähnlichen Geist getragen ist: Top-Institutionen, die gemeinsam etwas bewegen. Denn so geht es um Größenordnungen besser, als wenn es jeder allein versucht und nur auf sich schaut. Das wird auch zu gemeinsamer Wertschöpfung führen.
In den kommenden sechs Jahren wollen wir erste gemeinsame Innovationen auf den Weg bringen, von neuen diagnostischen Ansätzen bis hin zu Patenten und Ausgründungen. Ein wesentlicher Meilenstein ist die formalisierte Zusammenarbeit der Berliner Spitzenorganisationen. Das bietet für die Zukunft eine Plattform, über die sehr viel Gutes entstehen kann, was nicht nur der Medizin, sondern dem Innovationsstandort Berlin zugutekommen wird.
Das Thema ist riesig. Womit fangen Sie an?
Nikolaus Rajwesky: In der Vorbereitungsphase haben sich junge Forscher*innen institutionenübergreifend zusammengefunden und gemeinsam erste Anwendungsfälle definiert. Diese Bottom-up-Dynamik ist ein wichtiger Teil unseres Konzepts.
Um was geht es dabei?
Leif Erik Sander: Wir konzentrieren uns zunächst auf zwei Organkomplexe, für die ein hoher medizinischer Bedarf besteht. Ein Fokus liegt auf Demenzerkrankungen. Sie verursachen hohe Kosten und sind für Betroffene sowie ihre Familien äußerst belastend. In mehreren interdisziplinären Projekten suchen wir nach neuen Ansätzen für eine möglichst frühe Diagnose, um den Verlauf beeinflussen zu können. Der zweite Fokus sind chronische Lungenerkrankungen, ebenfalls Volkskrankheiten. Häufig ist unklar, wie sie entstehen. In der Therapie versuchen wir bisher, das Fortschreiten zu verlangsamen. Aber es wäre ja viel, viel besser, diese Erkrankungen deutlich früher zu erkennen und zu heilen.
Darüber hinaus untersuchen wir, wie Organsysteme miteinander kommunizieren. Schäden in einem Organ können an anderer Stelle im Körper Dominoeffekte auslösen. Solche systemischen Zusammenhänge waren in den bisherigen Krankheitssilos nicht unmittelbar erkennbar; wir fügen das jetzt zusammen. Die zwei ersten Fokusbereiche inspirieren hoffentlich andere, die Plattform des Einstein Centers zu nutzen.
Warum sollten Menschen sich untersuchen lassen, obwohl sie sich gesund fühlen?
Nikolaus Rajewsky: Das tun viele bereits, etwa bei der Mammographie, der Zahnvorsorge oder bei bekannten genetischen Risiken. Diese Prävention wird sich weiterentwickeln. Wichtig ist, die gesellschaftliche Debatte darüber offen und transparent zu führen.
Leif Erik Sander: Wenn wir hier in Deutschland mit seiner alternden Bevölkerung unsere Gesundheits- und Sozialsysteme erhalten wollen, dann geht es nicht ohne Prävention. Dieses Thema unbearbeitet zu lassen, wäre einer der größten strategischen Fehler, die man machen kann. Die Zahnmedizin ist ein tolles Beispiel. Die Kolleg*innen kennen kaum noch einen wirklich schlechten Zahnstatus. Die Menschen gehen zur Vorsorge, zur Zahnreinigung, auch wenn es nicht unbedingt das Angenehmste ist und man teils selbst zahlen muss. Aber es lohnt sich langfristig.
Der alte Spruch „There is no glory in prevention“ ist falsch. Nur wenn wir früher ansetzen und eine Heilung erzielen statt einer chronischen Dauertherapie, bleibt medizinischer Fortschritt finanzierbar.
Was fehlt bisher, um diesem Ziel näher zu kommen?
Leif Erik Sander: Es fehlt ausreichend Wagniskapital, wie überall in Europa. Dazu müssen auch politische und steuerliche Rahmenbedingungen verbessert werden. Und wir haben noch keine ausgeprägte Kultur, unsere Entdeckungen zu kommerzialisieren. Anders kommt das Wissen aber nicht ans Krankenbett! Aus Entdeckungen entstehen Medikamente, Tests, neue Geräte und irgendwann werden sie Teil der Versicherungsleistungen. So funktioniert die Medizin.
Es geht im Einstein Center auch um Wertschöpfung, denn so können Gewinne reinvestiert werden. Dadurch entsteht mehr Spitzenforschung und letztlich entstehen hoch qualifizierte und gut bezahlte Jobs. Im Einstein Center können wir in einem geschützten Rahmen exemplarisch zeigen, wie gemeinsame Innovation gelingen kann. Das kann eine Blaupause sein, denn aus meiner Sicht hat Berlin noch immer ein riesiges ungenutztes wirtschaftliches Potenzial im Biotech- und Life Science-Bereich.
Es ist eine Chance …
Nikolaus Rajewsky: Mich hat sehr positiv überrascht, mit welcher Begeisterung die Top-Wissenschaftler und Wissenschaftlerinnen in Berlin von Anfang an dabei waren. Das zeigt, dass wir einen Nerv getroffen haben.
Diese Stadt braucht neue Ideen, wie wir künftig wirtschaften wollen. Bis zum Zweiten Weltkrieg gab es hier viel Industrie. Dann kamen hauptsächlich Verwaltungen. In den letzten Jahren ist eine tolle Start-up-Szene entstanden. Aber wo Berlin wirklich exzellent ist, ist Biotech und Spitzenmedizin. Hier kann Wertschöpfung entstehen, die allen zugutekommt. Wir appellieren an die Politik in Berlin und im Bund, diese Chance zu nutzen.
In Boston ist ein riesiges Ökosystem rund um die Biotech-Industrie entstanden, das zum Wohlstand der ganzen Region beiträgt. Dort hat die Politik mit den Biologen gesprochen und gefragt, was sie brauchen. Die Antwort war: Rahmenbedingungen, die es erlauben, zügig voranzuschreiten. Das haben sie umgesetzt. Das Einstein Center ist ein Anfang, wir sind der Stiftung sehr dankbar für die Förderung. Es ist eine Einladung darüber nachzudenken, ob so eine Zukunftsidee Berlin nachhaltig attraktiv macht.
Die Fragen stellte: Jana Schlütter
Professor Nikolaus Rajewsky ist Direktor des Berliner Instituts für Medizinische Systembiologie des Max Delbrück Center. Professor Leif Erik Sander ist Direktor der Klinik für Infektiologie und Intensivmedizin der Charité – Universitätsmedizin Berlin. Beide gehören zum Sprecher*innenteam des Einstein Center for Early Disease Interception.
www.mdc-berlin.de
forschen, produzieren / 05.01.2026
Ein Spin-off gegen neuromuskuläre Leiden

Ein Team um Mina Gouti hat aus humanen Stammzellen ein Modell erschaffen, an dem sich neue Wirkstoffe gegen neuromuskuläre Krankheiten erproben und bestehende Therapien verfeinern lassen. Beim Start-up-Wettbewerb Science4Life ist die Idee für NMJCare als eine der zehn besten ausgezeichnet worden.
Die Spinale Muskelatrophie (SMA) ist eine der schwersten genetisch bedingten neuromuskulären Erkrankungen. Etwa eines von 10.000 Kindern kommt damit zur Welt. Trotz therapeutischer Fortschritte, die in den vergangenen Jahren erzielt wurden, ist die Krankheit bis heute unheilbar. Forschende sind daher weiterhin auf Modelle angewiesen, an denen sich neue Behandlungsansätze verlässlich und patientennah erproben lassen.
Ein solches Modell hat ein Team um Dr. Mina Gouti, die Leiterin der Arbeitsgruppe „Stammzell-Modellierung der Entwicklung und Erkrankung“ am Max Delbrück Center erschaffen: Die Wissenschaftler*innen haben aus patienteneigenen Stammzellen Gebilde gezüchtet, die die menschlichen Verbindungen aus Nervenfasern, Motoneuronen und Muskelfasern in ihren Funktionen sehr genau nachahmen. Dr. Ines Lahmann, Postdoktorandin im Labor von Gouti, möchte die wissenschaftliche Erfindung jetzt in ein marktreifes Konzept verwandeln – und überzeugte mit ihrem Projekt namens NMJCare beim bundesweiten Start-up-Wettbewerb Science4Life.
Unter mehr als 120 eingereichten Bewerbungen wurde NMJCare als eine der zehn besten Ideen ausgezeichnet. Das verschafft Lahmann Zugang zu Expert*innen, die sie bei der Entwicklung eines tragfähigen Geschäftsmodells begleiten. Auch das GeneNovate Entrepreneurship Programm wird NMJCare fördern. Dort erhält die Forscherin strategische Unterstützung in den Bereichen Gründung, Kommunikation und Geschäftsplanung. „All das sind zentrale Bausteine, um den Technologietransfer zielgerichtet voranzutreiben“, sagt Lahmann.
Ein Modell, viele Optionen
Für die Forscherin beginnt damit eine neue Phase. Neben wissenschaftlichen Fragen rücken Themen wie Patente, Zielgruppenanalysen und Finanzierungsstrategien in den Mittelpunkt. „Das sind Aspekte, mit denen ich mich früher kaum beschäftigen musste“, sagt Lahmann. „Jetzt aber entscheiden sie darüber, ob unsere Idee wirklich marktfähig wird.“ Das Potenzial von NMJCare sei jedenfalls groß: Mit dem Modell lassen sich im Hochdurchsatz Tausende potenzieller Wirkstoffe testen, bevor sie in aufwändige präklinische oder klinische Studien gehen.
Gleichzeitig eröffnet das System die Möglichkeit, besser zu verstehen, warum Patient*innen auf Therapien unterschiedlich ansprechen. „Das ist ein entscheidender Schritt auf dem Weg zu individuelleren Behandlungsansätzen“, sagt Lahmann. Die möglichen Nutzer*innen des Modells sind Pharmaunternehmen, akademische Forschungsteams oder Firmen auf dem Gebiet der personalisierten Medizin. An deren Wünsche lässt sich NMJCare flexibel anpassen, etwa durch die Wahl der Stammzelllinien oder die Ausrichtung auf kurz- oder langfristige Wirkstoffeffekte.
„Damit eine Idee wirklich tragfähig wird, braucht es ständigen Austausch – und auch kritische Perspektiven von außen“, sagt Lahmann. Im GeneNovate- und Science4Life-Programm trifft sie auf Gleichgesinnte sowie auf Mentor*innen aus den Bereichen Wirtschaft, Recht und Finanzwesen. Mit ihrer Hilfe soll sich NMJCare jetzt vom Laborprojekt in ein Spin-off verwandeln.
Pressemitteilung auf der Webseite des Max Delbrück Center
Ein Spin-off gegen neuromuskuläre Leiden
forschen, produzieren, heilen, bilden / 22.12.2025
Entdecken, erfinden, ausgründen – wie Innovation in der Biomedizin gelingt

Interview mit der Leiterin der Abteilung Innovation & Entrepreneurship am Max Delbrück Center, Dr. Nevine Shalaby
Was hat Sie an Ihrer Position am Max Delbrück Center gereizt?
Ich bin promovierte Genetikerin und habe in meiner Laufbahn sowohl fundierte Erfahrungen in der Wissenschaft als auch in der Industrie gesammelt. Für mich ist es deshalb sehr reizvoll, die Brücke zwischen der akademischen Forschung und der Industrie zu stärken. Den entscheidenden Impuls, die Stelle anzutreten, hat für mich ein erster Austausch mit den Erfinder:innen gegeben. Sie stellten sehr interessante Fragen zur Markteinführung ihrer Entdeckungen – allesamt hervorragende Innovationen. Hier am Max Delbrück Center geht es um exzellente Wissenschaft und bahnbrechende Erkenntnisse. Die Forschenden brennen für ihre Entdeckungen und wollen wissen, wie sie sie in Anwendungs- oder Ausgründungsideen umsetzen können. Dazu beizutragen, diese Innovationen in marktfähige Produkte umzuwandeln, ist für mich Ansporn und eine großartige Aufgabe.
Wie ist der Technologietransfer aufgestellt, und welche Impulse möchten Sie setzen?
Wir sehen derzeit, dass es am Max Delbrück Center viele Entdeckungen gibt, die sich als potenzielle Innovations- oder Transferprojekte eignen würden. Daher investieren wir viel Zeit in die Suche nach neuen Projekten. Dabei tauschen wir uns direkt mit den Wissenschaftler:innen aus, um ihre Arbeit zu verstehen. Ebenso intensiv arbeiten wir daran, das Marktpotenzial der von uns identifizierten Entdeckungen zu bewerten.
Seit Anfang 2025 haben wir mehr als 30 neue Projekte von über 15 leitenden Forscher:innen gescoutet, 15 dieser Projekte sind erstmals im Fokus. Dadurch konnten wir unser Innovationsportfolio in den Bereichen Diagnostik, Therapien, Forschungsinstrumente und Plattformen für die Wirkstoffforschung/Biomarker deutlich erweitern.
Im Innovation- und Entrepreneurship-Team konzentrieren wir uns auf drei Säulen. Erstens: Den Schutz des geistigen Eigentums durch eine effektive Patentierung, die die Ideen schützt, ohne die Veröffentlichung zu verzögern. Zweitens: Das Einwerben von Finanzierungen, die es den Forschenden ermöglichen, sich vollständig auf die Produktentwicklung zu konzentrieren. Und drittens: Eine proaktive Geschäftsentwicklung, um unsere Projekte frühzeitig mit den passenden Industriepartner:innen, Expert:innen und/oder Investor:innen zusammenzubringen. Dieser integrierte Ansatz stellt sicher, dass aus wissenschaftlichen Entdeckungen des Max Delbrück Center tatsächlich tragfähige Produkte werden können, die Patient:innen zugutekommen.
Wir wollen zeigen, dass Gründen ein kreativer und lohnenswerter Prozess ist. Deshalb fördern wir unternehmerisches Denken im gesamten Max Delbrück Center und integrieren unsere Forschenden stärker in das Innovationsökosystem Berlins. Erfolgreiche Gründungen tragen auch zu unserer Strategie 2030 bei: Sie helfen, Spitzenkräfte zu gewinnen, und verstärken unseren Impact in die Gesellschaft.
Wie fördern Sie den Übergang von Forschungsergebnissen in marktfähige Produkte?
Neben Scouting, Hilfe bei der Einwerbung von Finanzierungen oder dem Ausbau von Industriepartnerschaften setzen wir vor allem auf entsprechende Weiterbildung und Netzwerke. Interne Förderprogramme wie BOOST (Proof-of-Idea) und PreGoBio (Proof-of-Concept) helfen Projekten in kritischen Phasen. Wir haben BOOST kürzlich von der jährlichen auf eine fortlaufende Ausschreibung umgestellt. Forschende können sich nun bewerben, sobald sie eine Idee haben, und müssen nicht mehr monatelang auf die Förderung warten. Dadurch bieten jetzt mehr Kolleg:innen ihre Projekte an – und die Vorbereitung auf größere Zuschüsse oder externe Förderungen läuft schneller.
Unser Team unterstützt die Forschenden auch dabei, Fördermittel in Programmen wie Helmholtz Enterprise, ERC Proof-of-Concept oder Go-Bio des Bundesforschungsministeriums zu beantragen. Dabei werden zugleich Ideen so weiterentwickelt, dass diese leichter in ein Start-up oder in Lizenzvereinbarungen mit der Industrie überführt werden können.
Ein Start-up im Life-Science-Bereich zu gründen, erfordert neue Kompetenzen, ein Marktverständnis und die Einwerbung von Risikokapital. Mit welchen Formaten unterstützen sie dies?
Die Gründung von Start-ups erfordert sowohl das Engagement der Erfinder:innen als auch die Unterstützung unseres Teams. Wir stellen die richtigen Werkzeuge und Anleitungen bereit und helfen den Wissenschaftler:innen auch dabei, frühzeitig Kontakte zu Risikokapitalgeber:innen und erfahrenen Gründer:innen zu knüpfen. Dies hilft ihnen, die praktischen Aspekte der Gründung eines Start-ups besser zu verstehen. Darüber hinaus unterstützen wir die Teilnahme an Accelerator- und Inkubator-Programmen wie dem Digital Health Accelerator, dem CLIC Incubator von BIH und Charité und dem Creative Disruption Lab, die alle strukturierte Anleitung, Mentoring und Networking-Möglichkeiten bieten. Wir stellen auch spezielle Inkubationsräume auf dem Campus zur Verfügung, damit Gründer:innen ihr akademisches Labor verlassen und als „Sciencepreneurs“ an ihrem Produkt arbeiten können. Dieser Prozess ist keineswegs einfach, und wir unterstützen dies so gut wie möglich.
In Kooperation mit dem H3 Health Hub und anderen Instituten von Helmholtz bieten wir Workshops zu Pharmaentwicklung oder Regulierungsprozessen an, die nicht nur die einzelnen Schritte der Produktentwicklung vermitteln. Dort geben Expert:innen auch schon frühzeitig Feedback zum jeweiligen Produkt. Außerdem sind wir dabei, selbst Inkubator-/Accelerator-Programme aufzubauen. Und wir bringen die Forschenden bei Networking-Veranstaltungen oder Venture-Capital-Tagen mit Risikokapitalgebern und Industriepartnern zusammen.
Ein entscheidender Faktor für jedes Start-up ist das richtige Team.
Genau! Es ist zentral, von Beginn an wirtschaftliche Expertise in das Start-up-Projekt zu holen. Aus diesem Grund haben wir gerade die neue Position des „Entrepreneur-in-Residence“ geschaffen. Als erstes Beispiel wird Dr. Klaas Yperman mit Prof. Dr. Gary Lewin im Start-up „Allothera“ zusammenarbeiten, das kurz vor der Gründung steht und neue Therapien für Patient:innen mit neuropathischen Schmerzen entwickelt. Eine solche „Entrepreneur-in-Residence“-Position könnte mittelfristig regulär im Finanzplan verankert werden – als Alternative zu Postdoktorand:innen-Stellen, die sich ausschließlich auf wissenschaftliche Forschung konzentrieren. Damit schaffen wir die Voraussetzung, die wirtschaftlichen Potenziale herauszuarbeiten und heben auch die Chancen, Investoren zu begeistern.
Mit welchen strategischen Partnern arbeiten Sie zusammen?
Wir haben zahlreiche Partner im öffentlichen und im privaten Sektor. Als Teil der Helmholtz-Gemeinschaft arbeiten wir mit den anderen lebenswissenschaftlichen Zentren zusammen. In Berlin ist vor allem die strategische Partnerschaft mit der Charité – Universitätsmedizin und dem Berlin Institute of Health wichtig, mit denen wir dank der engen Verbindungen zwischen Wissenschaftler:innen und Kliniker:innen viele unserer Erfindungen teilen. Darüber hinaus kooperieren wir eng mit Industriepartnern wie Bruker bei der Weiterentwicklung von Hightech-Forschungsgeräten.
Nicht zuletzt versammelt der BiotechParkmit mehr als 70 Unternehmen, den Pharma Business Schools und dem Format „Talk im Cube“ der Berlin BioScience Academy eine große Expertise auf dem Campus. Durch Partnerschaften wie mit der UNITE-Initiative, der neuen Start-up-Factory für Berlin und Brandenburg, möchten wir die Unterstützung für unsere Forschenden in der Hauptstadtregion strukturell verbessern.
Ein zentrales Vorhaben ist es, einen Inkubator mit Laborräumen für Start-ups im Gründungszentrum BerlinBioCube zu etablieren.
Dies ist eine spannende Perspektive, auf die wir mit Nachdruck hinarbeiten. Derzeit haben wir mehrere Projekte in den Startlöchern, die den Schritt aus dem akademischen Umfeld wagen wollen – geleitet von „Sciencepreneurs“. Unser Ziel: Wir möchten diese Projekte dabei begleiten, aus unserem Inkubator in den BioCube umzuziehen – in das dynamische Ökosystem von Gleichgesinnten, die alle ähnliche Herausforderungen meistern. So fördern wir Austausch und Zusammenarbeit und letztlich gemeinsames Wachstum.
Quelle: Interview aus dem Standortjournal buchinside 01/2026
forschen / 19.12.2025
Wie sich das Schicksal einer T-Zelle entscheidet
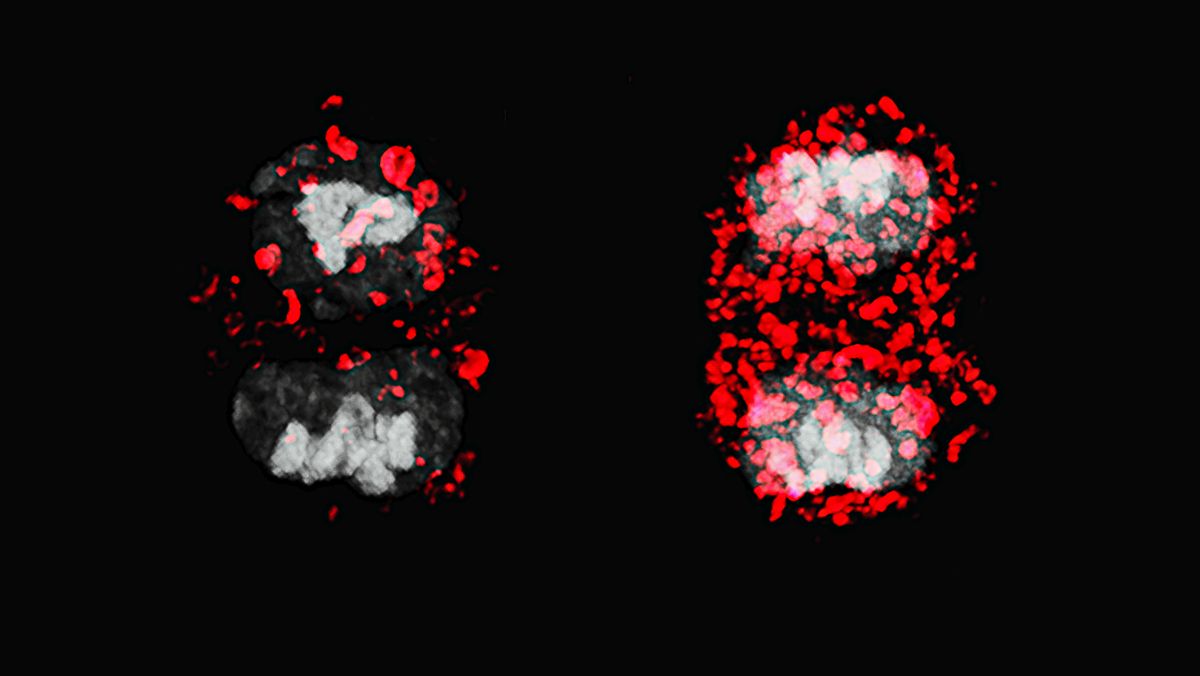
Ein zellulärer Reinigungsprozess, die Autophagie, trägt entscheidend dazu bei, dass T-Zellen sich richtig teilen. Das berichten Forschende um Katja Simon vom Max Delbrück Center in „Nature Cell Biology“. Die Studie könnte helfen, die Impfstoffreaktion älterer Menschen zu verbessern.
Wenn sich die T-Zellen unseres Immunsystems teilen, geschieht das in der Regel nicht symmetrisch. Die beiden Tochterzellen erben unterschiedliche Zellkomponenten, die über ihr weiteres Schicksal entscheiden: Eine Zelle wird zu einem kurzlebigen Kämpfer, der T-Effektorzelle; die andere entwickelt sich zu einer langlebigen T-Gedächtniszelle.
Eine Team um Professorin Mariana Borsa von der University of Oxford und Professorin Katja Simon, die Leiterin der Arbeitsgruppe „Zellbiologie der Immunität“ am Max Delbrück Center, hat jetzt gezeigt, dass die Autophagie – eine Art zellulärer Hausputz, bei dem die Zelle nicht mehr benötigte Bestandteile abbaut und recycelt – in dem Entscheidungsprozess dieser asymmetrischen Zellteilung (Asymmetric Cell Division, kurz ACD) eine entscheidende Rolle spielt.
„Unsere Studie beweist zum ersten Mal kausal, dass T-Zellen die ACD ohne Autophagie nicht normal durchlaufen“, sagt Borsa, Erstautorin der Studie und inzwischen als Professorin der Universität Basel ihre eigene Arbeitsgruppe leitet. „Wir haben herausgefunden, dass bei der Teilung einer T-Stammzelle die Tochterzellen unterschiedliche Mitochondrien erben – was ihr weiteres Schicksal beeinflusst. Wenn wir diesen Prozess verstehen, können wir darüber nachdenken, was sich tun lässt, um die Funktion der T-Gedächtniszellen im Alter zu erhalten.“
Gespaltene Persönlichkeit
Um die ACD detailliert zu untersuchen, nutzten die Forschenden ein neuartiges Mausmodell, MitoSnap genannt. In ihm lassen sich die Mitochondrien so markieren, dass man sie in Mutter- und Tochterzellen voneinander unterscheiden und getrennt verfolgen kann. T-Zellen enthalten viele dieser Zellorganellen, die vor allem für die Energieproduktion der Zellen erforderlich sind.
Das Team um Borsa und Simon untersuchte, wie alte, beschädigte Mitochondrien zwischen den Tochterzellen verteilt werden. Die Wissenschaftler*innen fanden heraus, dass in gesunden Zellen die Autophagie benötigt wird, damit eine Tochterzelle keine alten Mitochondrien erhält. Das wiederum führt dazu, dass sich diese Zelle zu einer langlebigen Gedächtnisvorläuferzelle entwickelt – einer Immunzelle, die sich an einen Erreger erinnert und sich schnell zu teilen beginnt, wenn sie erneut auf ihn stößt. Die andere Tochterzelle, die die alten Mitochondrien übernommen hat, entwickelt sich hingegen zu einer kurzlebigen Effektorzelle. Diese Zellen teilen sich schnell und wehren unmittelbare Bedrohungen ab. Ist die akute Gefahr beseitigt, sterben sie ab.
Wird die Autophagie gestört, bricht die sorgfältige Sortierung zusammen. Beide Tochterzellen erben dann beschädigte Mitochondrien und sind folglich dazu bestimmt, kurzlebige Zellen zu werden. „Es war überraschend zu sehen, dass die Autophagie eine Rolle spielt, die über die reine Zellpflege hinausgeht“, sagt Borsa. „Unsere Ergebnisse deuten darauf hin, dass die asymmetrische Vererbung von Mitochondrien ein potenzielles therapeutisches Ziel für die Verjüngung von T-Gedächtniszellen darstellt.“
Die Impfreaktion verstärken
Indem man die Autophagie vor oder während der Teilung der T-Stammzellen stimuliert, könnte es möglich sein, mehr Gedächtniszellen zu erhalten und auf diese Weise den langfristigen Schutz nach Infektionen oder durch Impfstoffe zu verbessern – so die Hoffnung der Forschenden.
In einem weiteren Schritt analysierte das Team die Tochterzellen mithilfe der Einzelzell-Transkriptomik, -Proteomik und -Metabolomik. Dabei stellten die Wissenschaftler*innen fest, dass Effektorzellen mit beschädigten Mitochondrien stark von einem bestimmten Stoffwechselweg, dem C1-Stoffwechsel, abhängig sind. Ihn gezielt zu manipulieren, könnte eine weitere Möglichkeit sein, das Immunsystem subtil zu beeinflussen und T-Stammzellen dazu zu bewegen, sich eher zu Gedächtnis- als zu Effektorzellen zu entwickeln, spekuliert Borsa.
„Langfristig könnte diese Forschung zu Strategien beitragen, um das alternde Immunsystem zu verjüngen, wodurch Impfstoffe wirksamer werden und der Schutz vor Infektionen gestärkt wird“, fügt Simon hinzu. Die Forschenden planen nun, ihre Ergebnisse in Experimenten mit menschlichen T-Zellen weiter zu validieren.
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft legt mit seinen Entdeckungen von heute den Grundstein für die Medizin von morgen. An den Standorten in Berlin-Buch, Berlin-Mitte, Heidelberg und Mannheim arbeiten unsere Forschenden interdisziplinär zusammen, um die Komplexität unterschiedlicher Krankheiten auf Systemebene zu entschlüsseln – von Molekülen und Zellen über Organe bis hin zum gesamten Organismus. In wissenschaftlichen, klinischen und industriellen Partnerschaften sowie in globalen Netzwerken arbeiten wir gemeinsam daran, biologische Erkenntnisse in praxisnahe Anwendungen zu überführen – mit dem Ziel, Frühindikatoren für Krankheiten zu identifizieren, personalisierte Behandlungen zu entwickeln und letztlich Krankheiten vorzubeugen. Das Max Delbrück Center wurde 1992 gegründet und vereint heute eine vielfältige Belegschaft mit rund 1.800 Menschen aus mehr als 70 Ländern. Wir werden zu 90 Prozent durch den Bund und zu 10 Prozent durch das Land Berlin finanziert.
Bild: T-Stammzellen durchlaufen normalerweise eine asymmetrische Zellteilung (links), bei der eine Tochterzelle zu einer langlebigen Gedächtnis-T-Zelle wird. Wenn die Autophagie gestört ist, erben beide Tochterzellen alte Mitochondrien (rot) und werden zu Effektor-T-Zellen.
Quelle: Pressemitteilung Max Delbrück Center
Wie sich das Schicksal einer T-Zelle entscheidet
- News
- Termine
- Standortjournal „buchinside“
- Presseservice/Download
-
News Archiv
- Archiv News 2025
- Archiv News 2024
- Archiv News 2023
- Archiv News 2022
- Archiv News 2021
- Archiv News 2020
- Archiv News 2019
- Archiv News 2018
- Archiv News 2017
- Archiv News 2016
- Archiv News 2015
- Archiv News 2014
- Archiv News 2013
- Archiv News 2012
- Archiv News 2011
- Archiv News 2010
- Archiv News 2009
- Archiv News 2008








